
题目列表(包括答案和解析)
1.常温下,将盛有10mL NO2和10mLNO混合气体的试管倒置在水中,并向其中通入氧气,一段时间后试管内尚余2mL气体,则通入氧气的体积为 ( BD )
A.7.5ml B.8.5ml C.10ml D.12ml
38.(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个化学方程式,并配平。
_________+__________→__________+__________+__________+______H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
38.(1)24FeSO4+30HNO3→8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O
(2)FeSO4 +5价N (3) 得到 4
37.①KBrO3>KIO3>Br2>I2 ②1∶6
③10I-+2BrO3-+12H+
5I2+Br2+6H2O ④I2、KIO3、Br2
37.已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
②Br2能将I-氧化为I2;
③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,其本身被还原为I2;
(1)KBrO3、Br2、KIO3、I2氧化能力由强到弱的顺序为 ;
(2)向含有1 mol KI的硫酸溶液中加入含a mol KBrO3的溶液,a的取值不同,所得的产物也不同。
①开始滴加KBrO3溶液时发生反应6KI+KBrO3+3H2SO4 3K2SO4+3I2+KBr+
3H2O,则
该反应中氧化剂与还原剂的物质的量之比为 ;
②当反应的氧化产物只有I2,还原产物只有Br2时,反应的离子方程式为: ;
③当a值为1时,氧化产物和还原产物的化学式分别为: 、 。
36.(1)分子(1分) P4(s)+5O2(g)=2P2O5(s);△H= 一2982 KJ/mol(3分)
(2) 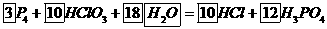 (3分)HClO3,(1分)
(3分)HClO3,(1分)
(3)H3PO4(1分) 120(1分)
36.白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。
(1)白磷是 晶体(填“离子”、“分子”、“原子”或“金属”),31 g白磷与足量的氧气完全燃烧释放出745.5 kJ的热量,请写出白磷燃烧的热化学方程式:
(2)已知白磷和氯酸溶液可发生如下反应;
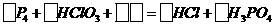 配平并完成上述反应方程式,标出电子转移的方向和数目,该反应的氧化剂是 。
配平并完成上述反应方程式,标出电子转移的方向和数目,该反应的氧化剂是 。
(3)白磷有毒,在实验室可采用CuSO4溶液进行处理,其反应为:
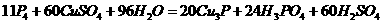
该反应的氧化产物是 ,若有11 mol P4参加反应,则有 mol电子转移。
35.(1)1、3x+1、2x-2、x、3x+1、x-1
(2)10、4、14H2SO4、4、5、3、14
35.完成并配平下列方程式:
Na2Sx+ NaClO+ NaOH = Na2SO4+ NaCl+ H2O
NaBiO3+ MnSO4+ = NaMnO4+ Bi2(SO4)3+ Na2SO4+ H2O
34. (1)14HNO3+3Cu2O = 6Cu(NO3)2+2NO↑+7H2O (2分)
(2)酸性(1分) 氧化性(1分) (3)0.6mol(2分)
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成(2分)
34.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e →NO + 2H2O KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: ;
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
____________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com