
题目列表(包括答案和解析)
4、氢镍电池是一种应用广泛的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电
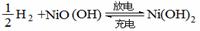 池的总反应为
。据此判断,下列叙述中正确的是( B)
池的总反应为
。据此判断,下列叙述中正确的是( B)
A.电池放电时,H2是正极
B.电池放电时,溶液中的阳离子移向正极
C.电池充电时,氢元素被氧化
D.电池放电时,电池负极周围溶液的pH不断增大
3、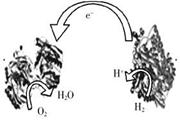 2006年,科学家们发明了一种能够给电子设备提供动力的 生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是( C)
2006年,科学家们发明了一种能够给电子设备提供动力的 生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是( C)
A.左边为该电池的负极
B.该电池可在高温环境下使用
C.该电池负极反应为:H2-2e-=2H+
D.该电池正极反应为O2+4e-=2O2-
2、下列叙述正确的是 ( D )
A.在电解池的阴极和原电池的负极上都发生氧化反应
B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2
D.用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH
1.如图所示,下列叙述正确的是( A)
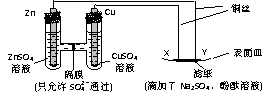

A.Y为阴极,发生还原反应 B.X为正极,发生氧化反应
C.Y与滤纸接触处有O2生成 D.X与滤纸接触处变红
31、⑴Au2O3、Na2S2O3、H2O、Na2S4O6、Au2O、NaOH
⑵Au Na2S2O3
⑶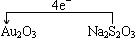 ⑷1:4
⑷1:4
本资料由《七彩教育网》 提供!
31.某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
⑴请将Au2O3之外的反应物与生成物分别填如以下空格内。

⑵反应中,被还原的元素是 ,还原剂是 。
⑶将氧化剂与还原剂填入下列空格中,并用单线桥标出电子转移的方向和数目。

(氧化剂) (还原剂)
⑷纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
30、(1)3(NH4)2SO4====4NH3+3SO2+N2+6H2O ,
(2)氧化产物为 N2 和还原产物为 SO2 其物质的量之比是 1:3
30、(1)写出硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水的反应方程式 ,
(2)该反应中生成的氧化产物为 和还原产物为 其物质的量之比是
29、 ③⑤⑥
29.实验室利用氧化还原反应制取的气体是
①HCl ② H2S ③ O2 ④ CO2 ⑤ Cl2 ⑥ NO ,(填序号)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com