
题目列表(包括答案和解析)
8.用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是
A、配制标准溶液的NaOH中混有Na2CO3杂质
B、滴定终点读数时,俯视滴定管的刻度,其他操作正确
C、盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D、滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
7.在一定条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol 现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应
放出的热量(Q)如下表所列:
2SO3(g);△H=-197kJ/mol 现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应
放出的热量(Q)如下表所列:
|
容器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述不正确的是
A.Q1=2Q2=2Q3=197
B.在上述条件下每摩该反应进行到底时放出的热量为197 kJ
C.在上述条件下反应生成1 molSO3气体放热98.5 kJ
D.2Q2=2Q3<Q1<197 kJ
6.在2L密闭容器中进行如下反应:mX(g)+nY(g)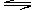 pZ(g)+qQ(g),2s时间内X表示的平均反应速率为0.3mpmol/(L·s),则2s时间内,Q物质增加的物质的量为
pZ(g)+qQ(g),2s时间内X表示的平均反应速率为0.3mpmol/(L·s),则2s时间内,Q物质增加的物质的量为
A.1.2qpmol B.1.2mpmol C.1.6pqmol D.0.6qpmol
5.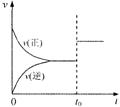 可逆反应aX(g)+bY(g)
可逆反应aX(g)+bY(g) cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
4.关于晶体的下列说法正确的是
A、在晶体中只要有阴离子就一定有阳离子
B、在晶体中只要有阳离子就一定有阴离子
C、原子晶体的熔点一定比金属晶体的高
D、分子晶体的熔点一定比金属晶体的低
3.高铁酸钾(K2FeO4)是一种新型.高效.多功能水处理剂,是比Cl2.O3.ClO2.KMnO4氧化性更强,无二次污染的绿色处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中:
湿法制备的主要反应方程为: Fe(OH)3+ClO-+OH-===FeO42-+Cl-+H2O
干法制备的主要反应为:FeSO4+Na2O2==Na2FeO4+Na2O+Na2SO4 +O2↑(均未配平)
下列有关说法不正确的是
A.高铁酸钾中铁显+3价 B.湿法中每生成1 mol Na2FeO4转移3 mol电子
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S.NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
2.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL l moL/L的盐酸;恰好使混合物完全溶解并放出标准状况下224mL气体。向所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为
A.11.2g B.2.8g C.5.6g D.无法计算
1. (NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4 =N2↑+6NH3↑+3SO2↑+SO3↑+7H2O。将反应后的混合气体通入BaCl2溶液,产生的沉淀为
A.BaSO4 B.BaSO3 C.BaS D.BaSO4和BaSO3
10.某恒温恒容容器中,建立如下平衡:2A(g)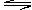 B(g),在相同条件下,若分别向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
B(g),在相同条件下,若分别向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
A.都增大 B.都减小
C.前者增大后者减小 D.前者减小后者增大
本资料由《七彩教育网》 提供!
9.食盐晶体如右图所示。在晶体中,· 表示Na+,o 表示Cl-。已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是
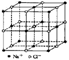
A. 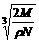 cm
B.
cm
B. 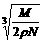 cm
cm
A. 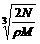 cm
D.
cm
D. 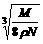 cm
cm
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com