
题目列表(包括答案和解析)
2、解析城市空气质量日报的内容是二氧化硫、氮氧化物和悬浮颗粒,而二氧化碳不属于此报道内容。
答案:C
例3、(2002·苏豫·22)高温下硫酸亚铁发生如下反应:
2FeSO4 Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是
A.BaSO3和BaSO4 B.BaS
C.BaSO3 D.BaSO4
1、解析酸雨的形成,主要与SO2的排放有关;光化学烟雾的形成,主要与烃类及氮氧化物有关;温室效应主要与烃类和CO2等有关。
答案:A
例2、(2000•上海•3)下列物质不属于“城市空气质量日报”报道内容的是
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
3.例题精讲
例1、(2000·全国·1)导致下列现象的主要原因,与排放SO2有关的是
A.酸雨 B.光化学烟雾
C.臭氧空洞 D.温室效应
3、酸雨的危害
(1)对人体健康造成危害。
(2)破坏森林、草原和农作物。
(3)使土壤酸性增强、湖泊酸化、生态环境受损。
(4)破坏建筑物。
2、一般认为,酸雨是由于人为排放的SO2和氮氧化物等酸性气体进入大气,当这些气体达到一定浓度后,在水凝结过程中溶于水形成硫酸和硝酸,使雨水酸性变大,pH变小。其转化可简单表示如下:
2SO2+2H2O+O2 2H2SO4
2H2SO4
NOx HNO3
HNO3
请大家看课本P128进行总结。
1、pH小于5.6的雨水,称之为酸雨。
2.实验室制法
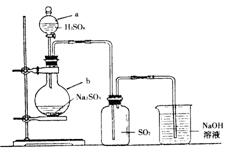
Na2SO3(s)+H2SO4(浓)===Na2SO4+SO2↑+H2O
实验中常使用溶质的质量分数为60%左右的硫酸,也可用浓硫酸。
不能用很稀的硫酸,因为SO2在水中的溶解度较大,常温常压下1体积水能溶解40体积的SO2
1.工业制法
a,硫磺燃烧法 S+O2 SO2
SO2
b,煅烧硫铁矿法4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(1)制硫酸;
(2)漂白纸浆、毛、丝、草帽等;
(3)杀菌消毒。
4、漂白性:SO2使品红溶液褪色
SO2能使某些有色物质褪色,是由于二氧化硫可跟某些有色物质化合成无色物质,而化合成的无色物质却是不稳定的,易分解而恢复原来有色物质的颜色。
漂白性的比较
|
|
具有漂白性的物质 |
||
|
物质 |
HClO、O3、H2O2 、Na2O2 |
SO2 |
木炭 |
|
原理 |
将有色物质氧化分解 |
与有色物质结合生成无色物质 |
将有色物质的分子吸附在其表面 |
|
实质 |
氧化还原反应 |
非氧化还原反应 |
物理吸附 |
|
效果 |
永久性 |
暂时性 |
暂时性 |
|
范围 |
可漂白大多数有色物质,能使紫色石蕊褪色 |
可漂白某些有色物质,不能使石蕊试液褪色 |
可吸附某些有色物质的分子 |
把Cl2和SO2混合用于漂白,能否增强漂白效果?为什么?
[答案]不能,SO2+Cl2+2H2O=== H2SO4+2HCl
SO2与CO2的相互鉴别
鉴别SO2气体的常用方法是用品红溶液,看能否使其褪色,有时还需再加热看能否再复原。
鉴别CO2气体的常用方法是用澄清石灰水,看能否使其变浑浊,足量时再变澄清。
当混有CO2时,不会影响SO2的鉴别;
当混有SO2时会干扰CO2的鉴别,应先除去SO2后再用澄清石灰水鉴别CO2气体。
除去CO2中的SO2,常用方法是使混合气体先通过足量溴水或酸性KMnO4溶液或饱和NaHCO3溶液(吸收SO2),再通过品红溶液(检验SO2是否被除尽)。
[新授]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com