
题目列表(包括答案和解析)
16.已知A、B、C、D是中学化学中常见的四种不同粒子。它们之间存在下图的转化关系。
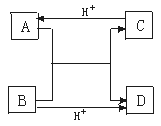
(1)如果A、B、C、D均是10电子的粒子,请写出:
A的结构式 ;D的电子式 。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式 ;
②根据上述离子方程式,可以判断C与B结合质子能力的大小是(用化学式或离子符号表示) > 。
15.1994年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图所示,呈V型,键角为116.5°。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)--三个O原子均等地享有这4个电子。请回答:
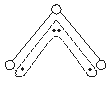
(1)臭氧与氧气的关系是 。
(2)写出下列分子与O3分子的结构最相似的是
A.H2O B.CO2 C.SO2 D.BeCl2
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子
有 对孤对电子。
(4)O3分子是否为极性分子 (是或否)。
(5)O3与O2间的转化是否为氧化还原反应(若否,请回答A小题;若是,请回答B小题)。
A.O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
PbS+ O3-- PbSO4+ O2
B.O3在催化剂作用下生成1 mol O2转移电子数 mol
14.处于相邻三个周期的元素A、B、C,原子序数依次增大,三者原子序数之和为25,且知B、C处于同一主族,1.8 g D与足量盐酸反应生成DCl3和2.24 L氢气(标况),E和D处于同周期,且E+和D离子具有相同的电子层结构,元素F和C能形成FC型离子化合物,又知C离子比F离子多一个电子层,试推断:
(1)六种元素的名称分别为A ,B ,C ,D ,E ,F 。
(2)用电子式表示A和C形成化合物的过程 。
12.在白磷分子中每个磷原子以 键与另外的 个磷原子相结合成 结构,键角为 。如果把一个白磷分子的每个P-P都打开插入一个氧原子,则一共可结合 个氧原子,这样得到的化合物的分子式为 。
13有A、B、C、D、E五种粒子,其组成均有氢元素,且电子总数为10个。A是双原子的阴离子,根据下列变化,写出粒子的化学式及B粒子的空间结构。
①A+B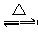 C+D↑ ②2C
C+D↑ ②2C A+E
A+E
③D+E===B+C
则A ,B ,C ,D ,E 。B的形状是 ,C的电子式是 。
11. AB2离子化合物的阴、阳离子的电子层结构相同,1 mol AB2分子中含有54 mol电子,根据下列反应:
①H2+B2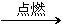 C
C
②B2+X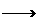 Y+AB2+H2O
Y+AB2+H2O
③Y+C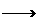 AB2+Z,Z有漂白作用
AB2+Z,Z有漂白作用
(1)写出下列物质的化学式AB2 ,X ,Y ,Z 。
(2)用电子式表示AB2的形成过程 。
(3)写出反应②的化学方程式 。
10.(7分)写出下列粒子的电子式:
(1)硫原子 ,(2)镁离子 ,
(3)氢氧根离子 ,(4)氮气 ,
(5)过氧化钠 ,(6)氯化铵 ,
(7)氮化镁 。
9.三氯化氮NCl3在常温下是一种淡黄色气体,其分子呈三角锥型,以下关于NCl3叙述正确的是
A.NCl3分子中的电荷分布是均匀、对称的
B.NCl3分子是非极性分子
C.NCl3分子中不存在孤对电子
D.分子中所有原子最外层都达到8个电子的稳定结构
8.1998年中国十大科技成果之一是合成一维纳米氮化镓。已知镓是第三主族元素,则氮化镓的化学式可能是
A.Ga3N2 B.Ga2N3
C.GaN D.Ga3N
7.氢化铵(NH4H)与氯化铵的结构相似,已知NH4H与水反应有H2生成,下列叙述不正确的是
A.NH4H是离子化合物,含有离子键和共价键
B.NH4H溶于水,所形成的溶液显碱性
C.NH4H与水反应时,NH4H是氧化剂
D.将NH4H固体投入少量水中,有两种气体产生
6.1999年曾报道合成和分离了含高能量的正离子N 的化合物N5AsF6,下列叙述中错误的是
的化合物N5AsF6,下列叙述中错误的是
A.N 共有34个核外电子
共有34个核外电子
B.N 中氮-氮原子间以共用电子对结合
中氮-氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+1
D.化合物N5AsF6中F的化合价为-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com