
题目列表(包括答案和解析)
6. (02全国高考) 周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是 ( ) A.电子数 B.最外层电子数 C.电子层数 D.次外层电子数
5. (02.宣武) 下列说法是报纸和广告中的用语,其中正确的是 ( )
A. 某报纸报道“从尿液中分离出的‘青春素’是一种对人体有益的元素”
B. 长期饮用纯净的蒸馏水比饮用矿泉水对人体有益
C. 某广告称:负氧离子发生器由于产生O3,对人体有益无害
D. 与夏季比较,冬季大气中的SO2含量偏高,这主要是燃烧含硫煤造成的
4. (03.上海) 13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt W üthrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是 ( ) A. 13C与15N有相同的中子数 B. 13C 与C60互为同素异形体
C.15N 与14N互为同位素 D. 15N的核外电子数与中子数相同
3. (03.广州.五月) 中国科学院近代物理研究所合成了23991Pa原子,在世界尚属首次,下列有关该原子的说法不正确的是 ( )
A.该原子属于一种金属原子B.该原子核内中子数 为148 C .合成该原子就是创造了一种元素 D.这种原子具有放射性
2.(02全国理科综合测试)目前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克组成。u夸克的带电量为2e/3,d夸克的带电量为-1e/3,e为基本电荷。下表中关于质子和中子组成的两类夸克数目论断可能确的是 ( )
1.与OH- 有相同质子数和电子数的微粒是( ) A.Cl- B.F- C.NH2- D.NH3
|
|
A |
B |
C |
D |
|
|
质子 |
u夸克 |
1 |
2 |
1 |
2 |
|
d夸克 |
2 |
1 |
2 |
1 |
|
|
中子 |
u夸克 |
1 |
1 |
2 |
1 |
|
d夸克 |
2 |
2 |
1 |
1 |
4.实战演练
3. 例题精讲
例1.(全国高考)科学家最近制造出第112号新元素,其原子的质量素为277,这是迄今已知元素中最重的原子。关于该新元素的下列叙述正确的是( )
A.其原子核内中子数和质子数都是112 B. 其原子核内中子数为165,核外电子数为112 C.其原子质量是12C原子质量的277倍 D. 其原子质量与12C原子质量之比为277:12
解析:原子核内的质子数等于原子的核外电子数,等于原子序数。质量数等于原子核内的质子数与中子数之和。第112号元素有112个质子,其原子有112个电子。因它的质量数是277,所以中子数为277-112=165,故A不正确,B正确。某种原子的相对原子质量,是该原子的质量与12C同位素原子质量的1/12之比,而不是与12C原子质量之比,所以C不正确,D正确 答案:BD
命题意图:本题意在考查组成原子的微粒间的关系。本题只涉及一种同位素原子的质量数和相对原子质量,如果涉及多种天然同位素时,其相对原子质量是各有关天然稳定同位素的原子所占的原子百分数(即丰度)与各上述同位素的相对原子质量算出来的平均值。
例2.有A、B、C、D四种元素,A元素的原子得2个电子,B元素的原子失去2个电子后所形成的微粒均与氖原子有相同的电子层结构。C元素的原子只有1个电子,D元素原子的电子层电子数比层电子数多6个。试写出A、B、C、D的元素符号和名称,并画出A、B两元素的离子结构示意图。
解析:A原子得2e-和B原子失去2e-形成的阴、阳离子和氖原子具有相同的电子层结构,(即核外有10e-),所以A的核电荷数为10-2=8;B的核电荷数为10+2=12,因此A为氧元素、B为镁元素。C的原子只有1e-,所以C为氢元素。而D原子第M层电子数比N层电子数多6个,因此D原子的K层有2e-,L层有8e-,核外共有20e-,质子数为20,应为钙元素。
答案:A:O(氧)B:Mg(镁)C:H(氢)D:Ca(钙)A2-: B2+:
命题意图:原子结构的特点和规律是研究物质结构的基础。本题的主要考查意图在于检查考生能否灵活运用有关规律进行分析和推断元素。
例3:X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可能表示为( )A.XY B.XY2 C.XY3 D.X2Y3
解析:根据题意X可能为Li或Si。若X为Li,则Y是H,可组成LiH即XY;若X为Si,则Y为Li,Li和Si不能形成化合物。答案:A
命题意图:本题主要考查1∽18号元素的原子核外电子排布的特点及核外电子的排布规律
例4设某元素某原子核内的质子数为m,中子数为n,则下述论断中正确的是
A. 不能由此确定该元素的相对原子质量
B. 这种原子的相对原子质量为m+n
C. 若碳原子质量为wg,此原子的质量为(m+n)wg
D. 核内中子的总质量小于质子的质量
[解析]元素的相对原子质量和原子的相对原子质量是两个不同的概念,要求元素的相对原子质量,必须知道其各种同位素的相对原子质量和原子个数百分数,否则无法求解,故选项A正确。质子数m+中子数n应为质量数,不是相对原子质量,选项B错误。由相对原子质量的数学表达式可知,某原子的质量=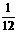 ×一种碳原子质量×该原子的相对原子质量,故选项C错误。1个质子的质量略小于1个中子的质量,但核内质子的总质量与中子的总质量还要取决于质子和中子数目的多少,选项D错误。
×一种碳原子质量×该原子的相对原子质量,故选项C错误。1个质子的质量略小于1个中子的质量,但核内质子的总质量与中子的总质量还要取决于质子和中子数目的多少,选项D错误。
本题正确答案为A。本题要求熟悉有关的基本概念,要注意区分一些易混淆的概念,如相对原子质量与质量数,元素的相对原子质量与原子的相对原子质量,核素与同位素等。
例5周期表中相邻的A、B、C三元素中,A、B同周期,A、C同主族。已知三种元素的原子最外层电子数之和为19,三种元素的原子核中质子数之和为41。则这三种元素是A______、B_______、C________、D_________(填元素符号)。
[解析]本题采用平均值法解答比较简单。由A、B、C三元素为相邻元素以及它们的平均质子数41/3≈14<18,可知A、B、C三元素为短周期元素;又根据最外层电子数的平均值19/3≈6.3<7,推知其中必有最外层电子数为7的元素,所以A、B、C三种元素应分布在ⅥA、ⅦA族,经推断A为S,B为Cl、C为O符合题意。
例6已知某主族金属元素X的原子核内质子数和中子数之比为1:1,含该金属阳离子0.192g的溶液恰好能将20mL0.4mol/L的Na2CO3溶液中的CO32-全部沉淀,推断X是什么元素及在周期表中的位置。
[解析]周期表中质子数与中子数相等的金属元素只有Mg和Ca两种,它们都是+2价金属。设金属的相对原子质量为M,由关系式 X2+-Na2CO3得:M:1=0.192:(0.4×0.02),解得M=24。则X为镁,位于第3周期第ⅡA族。
7.知识网络
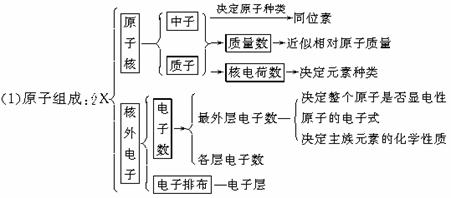
6.微粒半径大小比较规律
⑴同周期元素(稀有气体除外)的原子半径随原子核电荷数的递增逐渐减小。
⑵同主族元素的原子半径和离子半径随着原子核电荷数的递增逐渐增大。
⑶电子层结构相同的离子,核电荷数越大,则离子半径越小。
⑷同种元素的微粒半径:阳离子<原子<阴离子。
⑸稀有气体元素的原子半径大于同周期元素原子半径。
⑹电子层数多的阴离子半径一定大于电子层数少的阳离子半径,但电子层数多的阳离子半径不一定大于电子层数少的阴离子半径。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com