
题目列表(包括答案和解析)
63.分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上。其晶体中的阴离子晶胞结构如图示,下列说法不正确的是
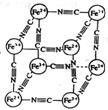 A.该晶体是离子晶体
A.该晶体是离子晶体
B.M的离子位于上述晶胞面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价,且M+空缺率为50%(体心中没有M+占总体心的百分比)
D.晶体的化学式可表示为MFe2(CN)6,且M为+1价
62.硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以用投影图表示成:
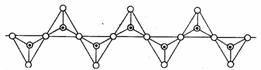
其中○表示氧原子,中心黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成各种不同的硅酸根离子。试确定在无限长的单链阴离子中(见图),硅原子与氧原子的个数之比为 B
A.1:2 B.1:3 C.2:5 D.2:7
61.将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。.则下列说法不正确的是
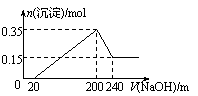 A.镁和铝的总质量为9 g
A.镁和铝的总质量为9 g
B.最初20 mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
60.铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C Pb+CO;PbO+CO
Pb+CO;PbO+CO Pb+CO2。下列说法正确的是
Pb+CO2。下列说法正确的是
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1 molPb共转移2 mol电子
D.将1mol PbS冶炼成Pb理论上至少需要6 g碳
59.已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1)△H=―Q1 KJ/mol 2H2(g)+O2(g)==2H2O(g) △H=―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol 常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少KJ
A.0.4Q1+0.1Q2 B. 0.4Q1+0.05Q2 C. 0.4Q1+0.1Q3 D.0.4Q1+0.05Q3
58.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是
A.CH3OH(l)+3/2O2(g) → CO2(g)+2H2O(l) △H=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g)→ 2CO2(g)+4H2O(l) △H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)→ 2CO2(g)+4H2O(l) △H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)→ 2CO2(g)+4H2O(l) △H=+1452 kJ/mol
57.已知热化学方程式:SO2(g)+
1/2O2(g) 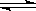 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
A. <196.64kJ B. 196.64kJ/mol C. 196.64kJ D. >196.64kJ
56.下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H1 C(s)+1/2O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+1/2O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
55.据最新报道,清华才女朱令11年前离奇的铊中毒案,再次引起人们关注。铊盐与氰化钾被列为A级危险品。铊(Tl)的原子序数为81,Tl3+与Ag在酸性条件介质中发生反应:Tl3++2Ag=Tl++2Ag+,Ag++Fe2+=Ag+Fe3+.下列推断不正确的是
A.Tl+最外层有2个电子 B.氧化性:Tl3+>Fe3+>Ag+>Fe2+>Al3+
C.还原性:Tl>Fe>Ag D.铊位于第六周期,第IIIA族
54.向200mL 0.5mol/L的稀硝酸溶液中加入0.54g铝粉,放出448mL (标况) NO气体,经充分反应后,向所得溶液中,加入0.5mol/L NaOH溶液,生成 0.78g沉淀。加入氢氧化钠溶液体积可能为
A.100mL B.150mL C.180mL D.200mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com