
题目列表(包括答案和解析)
4.实战演练
3.例题精讲
例1.把铜粉和过量的铁粉加入到热的浓硝酸中,充分反应后,溶液中大量存在的金属阳离子是 ( )
A.只有Fe2+ B.只有Fe3+
C.有Fe2+和Cu2+ D.有Fe3+和Cu2+
思路与解析:浓硝酸具有强氧化性,热的浓硝酸可将Fe和Cu分别氧化成Fe3+和Cu2+,过量的铁又与Fe2+和Cu2+反应生成Fe2+和Cu,所以充分后,溶液中大量存在的金属阳离子为Fe2+,故选A。
例2.将6g纯铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中充分反应后得到200mL0.5mol/L的FeSO4溶液和5.2g固体,求:
(1)反应后生成铜多少克?
(2)加入铁粉前Fe2(SO4)3物质的量浓度。
[思路]:在Fe2(SO4)3和CuSO4的混合溶液中投入铁粉后,Fe3+和Cu2+均可与铁发生反应,但由于氧化性Fe3+>Cu2+,所以Fe应首先还原Fe3+,即首先发生反应:Fe+2Fe3+=3Fe2+,但不可以只发生此反应,原因有二:第一是若只发生此反应则说明铁粉较少,已完全反应无剩余,则不可能有5.2g不溶物;第二,若只发生此反应可依此反应计算出生成的FeSO4为(6g÷56g/mol)×3=0.32mol>0.1mol。通过以上分析,可以看出,Fe在把全部的Fe3+还原后,不发生了还原Cu2+的反应,此时的Fe是否有剩余呢?也就是余5.2g固体中肯定有Cu,是否含Fe呢?这就是此题的关键所在,需通过计算推导确定。
[解析]:发生反应的化学方程式为:
①Fe+Fe2(SO4)3=3FeSO4 ②Fe+CuSO4=Cu+FeSO4
两个反应共生成FeSO4为:0.2L×0.5mol/L=0.1mol
观察两个反应不难发现,若生成同样的FeSO4,②式消耗的铁更多。假设0.1molFeSO4全部为②式产生,则此时消耗的铁将达最大量为a。
Fe - FeSO4
1mol 1mol
a 0.1mol
a=0.1mol,即铁为5.6g,则5.2g固体中含Cu也含剩余的Fe,设原溶液的Fe2(SO4)3和CuSO4的物质的量分别为x和y。
Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=Cu+FeSO4
X x 3x y y y y
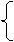 由题意得 3x+y=0.1mol
由题意得 3x+y=0.1mol
6g-56g/mol×(x+y)+64g/mol×y=5.2g
解得:x=0.02mol y=0.04mol
则生成铜:0.04mol×64g/mol=2.56g
原Fe2(SO4)3和物质的量浓度为0.02mol/0.2L=0.1mol/L
例3.mg 铁粉与一定量的HNO3在一定条件下充分反应,将生成的气体与标准状况nL氧气混合,恰好能被水完全吸收,m和n的关系是什么?
[思路]此题看起来,涉及的化学反应相当复杂,因HNO3的浓度和用量不同,生成Fe(NO3)3还是Fe(NO3)2不能确定,HNO3的还原产物是NO还是NO2也不能确定。所以消耗的氧气也无从下手求出.但是从始态和终态来看,HNO3的还原产物与氧气混合后,最终还是生成HNO3,这样消耗的氧气相当于把mg铁粉氧化成+2价或+3价化合物,用极端思考法很容易求出。
[解析]:假设HNO3为稀的,铁与HNO3反应后的价态是+2,
则有: 3 Fe +8 HNO3= 3 Fe(NO3)2 + 2 NO↑+ 4 H2O (1)
4NO +3O2 +2H2O=4HNO3 (2)
(1)×2 +(2)得:2Fe + O2 +4HNO3= 2Fe(NO3)2 +2H2O
可改写为 : 2Fe + O2 +4HNO3 = 2FeO + 4HNO3
即: 2Fe + O2 =2FeO
同理可得 : 4Fe +3O2=2Fe2O3 问题便得以解决
即 :当铁被氧化为+2价时,由电子得失守衡得:
m/56×2=n/22.4×4 n=O.2m
当铁被氧化为=+3价时,由电子得失守衡得:
m/56×3=n/22.4×4 n=O.3m
则m与n的关系是:O.2m≤n≤O.3m
[小结]此题在解题过程中,巧妙得使用了始态和终态,使复杂的问题简单化。氧化还原反应中,电子得失守衡的使用,避免了繁琐的计算,在应试中赢得了时间,思维训练方面堪称是一道好题。
例4.由FeO、Fe2O3和Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21:8,,则这种混合物中FeO、Fe2O3和Fe3O4的物质的量之比是( )。
A.1:2:1 B. 2:1:1 C. 1:1:1 D. 1:1:3
[思路]:可用平均组成法来求解:
[解析]在混合物中Fe原子和氧原子物质的量之比为(21/56):(8/16)=3:4,则混合物的平均组成为Fe3O4,在三种组合中Fe3O4则不必多考虑,应注意FeO和Fe2O3混合后也应符合Fe3O4,所以在混合物中它们的物质的量之比必需是1:1.故答案应选C、D。
例5.某铁的“氧化物”样品,用5mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+。该样品可能的化学式是 ( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
[思路]:利用正、负电荷相等列方程可快速解题。
[解析]设铁的氧化物中含O2-为xmol,则其化学式为FexOy,由O2-个数守恒有:
2yH++ FexOy = yH2O+ xFe+(2y/x)
2ymol ymol
2.Fe2+和Fe3+的颜色
Fe2+在水溶液中通常以水合离子[Fe(H2O)6]2+形式存在,呈淡绿色,并存在下列平衡:
[Fe(H2O)6]2++H2O [Fe(H2O)5OH]++H2O+
[Fe(H2O)5OH]++H2O+
这个平衡的pK=9.5,水解的程度很小,溶液近于中性.
Fe3+在酸性溶液中,通常以淡紫色的[Fe(H2O)6]3+形式存在.三氯化铁以及其他+3价铁盐溶于水后都发生显著的水解,实质是+3价水合铁离子的水解.只有在PH=0左右时,才有[Fe(H2O)6]3+存在(但由于有阴离子的存在,会生成其他的络离子,影响淡紫色的观察).当PH为2-3时,水解趋势很明显.它们的水解平衡如下:
[Fe(H2O)6]3++H2O [Fe(H2O)5(OH)]2++H3O+
[Fe(H2O)5(OH)]2++H3O+
K=10-3.05
[Fe(H2O)5(OH)]2++H2O [Fe(H2O)4(OH)2]++H3O+
[Fe(H2O)4(OH)2]++H3O+
K=10-3.26
生成的碱式离子呈黄色,它可聚合成二聚体:
2[Fe(H2O)6]3+ [Fe2(H2O)8(OH) 2]4++2H3O+
[Fe2(H2O)8(OH) 2]4++2H3O+
K=10-2.91
二聚体是借OH-为桥把2个Fe3+连结起来形成的多核络离子.溶液的PH越高,水解聚合的倾向越大,最后逐渐形成胶体,析出红综色水合氧化铁沉淀。
1.Fe2+和Fe3+的相互转化
Fe2+有还原性,高锰酸钾、重铬酸钾、过氧化氢等氧化剂能把它氧化成Fe3+:
MnO-4+5Fe2++8H+=Mn2++5Fe3++4H2O
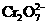 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
H2O2+2Fe2++2H+=2F3++2H2O
在酸性溶液中,空气中的氧也能把Fe2+氧化:
4Fe2++O2+4H+=4Fe3++2H2O
在碱性溶液中,Fe2+的还原性更强,它能把NO-3和NO-2还原成NH3,能把Cu2+还原成金属铜.Fe3+具有氧化性,它能把I-氧化成I2:
2Fe3++2I-=2Fe2++I2
在无线电工业上,常利用FeCl3溶液来刻蚀铜,制造印刷线路,它们反应的化学方程式是:
2Fe3++Cu=2Fe2++Cu2+
因此,铜在氯化铁溶液中能作还原剂,而FeCl3是氧化剂.
Fe3+在酸性溶液中容易被H2S、SnCl2等还原成Fe2+:
2Fe3++H2S=2Fe2++S↓+2H+
2F3++Sn2+=2Fe2++Sn4+
Fe3+还能被金属铁还原:
2Fe3++Fe=3Fe2+
在亚铁盐溶液中加入铁钉可防止Fe2+被氧化为Fe3+.
4.Fe2+和Fe3+的检验
(1)Fe2+的检验:
方法一:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色。
方法二:滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为灰绿色,最后变为红褐色。
(2)Fe3+的检验:
方法一:滴加KSCN溶液或NH4SCN溶液,溶液立即变为血红色。
方法二:滴加NaOH溶液,出现红褐色沉淀。
3.具体反应有:
(1)Fe2+→Fe3+
①2Fe2++Cl2=2Fe3++2Cl-(在亚铁盐溶液中通入氯气,溶液由浅绿色变为棕黄色)。
②4Fe2++O2+4H+=4Fe3++2H2O(亚铁盐溶液在空气中容易变质,如绿矾露置于空气中则是:12FeSO4+3O2=4Fe2(SO4)3+2Fe2O3)
③3Fe2++NO3-+4H+=3Fe3++2H2O+NO↑
④5Fe2++MnO4-+8H+=5Fe3++4H2O+Mn2+
如在FeCl2溶液中滴加酸性KMnO4溶液,溶液由浅绿色变棕黄色,在酸性KMnO4溶液滴加FeCl2溶液,溶液由紫红变棕黄。
⑤2Fe2++H2O2+2H+=2Fe3++2H2O
(2)Fe3+→Fe2+
①2Fe3++S2+=2Fe2++S,如在FeCl3溶液中滴加适量的Na2S溶液,溶液变浑浊,滤去沉淀则滤液为浅绿色;如加入过量的Na2S溶液,,则又有黑色沉淀生成(FeS),向Fe3+溶液中通入H2S气体的离子方程式为:2Fe2++H2S=2Fe3++2H++S↓。
②2Fe3++SO32-+2H2O=2Fe2++SO42-+2H+
③2Fe3++Fe=3Fe2+,在FeSO3溶液中往往要加铁的原因是可以防止Fe2+被氧化为Fe3+。
④2Fe3++Cu=2Fe2++Cu2+,电路板的制作是利用FeCl3溶液与裸露的铜反应。
⑤2Fe3++2I-=2Fe2++I2
2.铁元素的原子在化学反应中,当遇弱氧化剂(如S、H+、Cu2+、I2等)时,铁只能失去最外层的两个电子,而生成+2价铁的化合物,当遇到强氧化剂(如Cl2、Br2、HNO3等)时,铁原子可以再失去次外层上的一个电子而生成+3价铁的化合物.
从Fe、Fe2+和Fe3+的结构可知:Fe只有还原性,Fe3+通常只有氧化性,Fe2+既具有氧化性又具有还原性。上述微粒通过跟一定的氧化剂或还原剂发生氧化还原反应,才能实现不同价态的铁相互转化,如下图(常称为铁三角):
Fe


 Cl2
Cl2
CO Fe3+ CO O2
Zn Cu2+ H2 HNO3
I-、I2、S Al KMnO4
Cl2、O2、HNO3、KMnO4、H2O2
Fe2+ Fe、Cu、I-、S2-、H2S Fe3+
(溶液为绿色) (溶液为棕黄色)
1.学习铁及其化合物的性质要注意:
(1)抓价态:从铁元素三种价态的相互转化(铁三角关系)去认识铁及其化合物间的氧化-还原反应规律.
(2)想属类:如铁是一种比较活泼的过渡金属,氧化亚铁、氧化铁为碱性氧化物,氢氧化亚铁、氢氧化铁为不溶性弱碱,氯化铁为强酸弱碱盐,由此去分析理解它们各自所具有的性质.
2.Fe(OH)2和Fe(OH)3从溶液中析出的现象不同,前者是白色絮状沉淀,后者是红褐色沉淀。而Fe(OH)2极不稳定,易被氧化成Fe(OH)3,反应现象是:白色→灰绿色→红褐色。
若要观察到白色的Fe(OH)2沉淀,需要创造以下条件:
(1)排除亚铁盐溶液里的Fe3+离子,以免Fe3+离子直接与OH-结合生成Fe(OH)3。
(2)尽量排除溶液中溶解的氧气(绝对排除是办不到的),以减慢生成的Fe(OH)2被氧化成Fe(OH)3的速度。
反应要用新制备的亚铁盐溶液,并放入少量的铁以防止Fe3+离子产生。亚铁盐溶液与碱溶液在混合前分别加热以排除溶有的空气,然后,把碱溶液沿着试管壁加入盛亚铁盐溶液的试管中,或把滴管尖嘴直接插入液面下再加入碱溶液,可观察到白色絮状沉淀。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com