
题目列表(包括答案和解析)
4、滴定实验所用的仪器和操作要点
(1)仪器:酸式滴定管、碱式滴定管、滴定管夹(带铁架台)、锥形瓶(或烧杯+玻棒)、量筒(或移液管)。
(2)操作:①滴定前的准备:查漏、洗涤、润洗、充液(赶气泡)调液面、读数。②滴定:移液、滴加指示剂、滴定至终点、读数。③计算。
(3)滴定管“0”刻度在上。
3、滴定方法的关键
(1)准确测定两种反应物的溶液体积
(2)确保标准液、待测液浓度的准确
(3)滴定终点的准确判定(包括指示剂的合理选用)
2、中和滴定原理
由于酸、碱发生中和反应时,反应物间按一定的物质的量之比进行,基于此,可用滴定的方法确定未知酸或碱的浓度。
对于反应: HA + BOH====BA+H2O
1mol 1mol
C(HA).V(HA) C(BOH).V(BOH)
即可得 C(HA).V(HA)=== C(BOH).V(BOH)
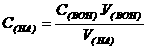
若取一定量的HA溶液(V足),用标准液BOH[已知准确浓度C(标)]来滴定,至终点时消耗标准液的体积可读出(V读)代入上式即可计算得C(HA)
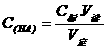
若酸滴定碱,与此同理
若酸为多元酸, HnA + nBOH===BnA+nH2O
1mol nmol
C(HA).V(HA) C(BOH).V(BOH)
则有关系: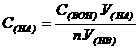
1、 中和反应:酸+碱
正盐+水
中和反应:酸+碱
正盐+水
如:①Hcl+NaOH===NaCl+H2O
②H2SO4+2NaOH====Na2SO4+2H2O
③N3PO4+3NaOH====Na3PO4+3H2O
注意:①酸和碱恰好完全中和,溶液不一定呈中性,由生成的盐性质而定。
②由于所用指示剂变色范围的限制,滴定至终点不一定是恰好完全反应时,但应尽量减少误差。
15、Fe(OH)3胶体;NaOH溶液 硅酸胶体 As2S3胶体
14、带负电荷的陶土胶粒;带正电荷的氧化铁胶粒;
这两种胶粒在通直流电时发生电泳。
13、(1)⑧;(2)②;(3)⑩;(4)③;(5)①;(6)③
7、A 8、BC 9、D 10、A 11、AD 12、B
1、B 2、D 3、C 4、B 5、AD 6、BD
15、有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸胶体、As现将有关实验现象记录如下:
(1)电泳:甲液体的阳极周围颜色变浅,阴极周围颜色变深;
(2)将一束光通过乙液体,无丁达尔现象;
(3)将乙慢慢地加入到丙液体中,先出现凝聚,后液体变清。试推断甲为 ,乙为 ,丙为 ,丁为 。
[练习答案]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com