
题目列表(包括答案和解析)
6、下列仪器中,没有“0”刻度线的是( )
A、温度计 B、量筒 C、酸式滴定管 D、托盘天平游码刻度尺
5、准确量取25.00mL高锰酸钾溶液,可选用的仪器是( )
A、50mL量筒 B、10mL量筒
C、50mL酸式滴定管 D、50mL碱式滴定管
4、用0.1mol·L-1NaOH溶液滴定0.1mol·L-1盐酸,如达到滴定终点时不慎多加了1滴NaOH(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的PH是( )
A、4 B、7.2 C、10 D、11.3
3、用盐酸滴定NaOH溶液的实验中,以甲基橙为指示剂,滴定到终点时,溶液颜色的变化是( )
A、由黄色变为红色
B、 由黄色变为橙色
C、 由橙色变为红色
D、由红色变为橙色
2、有已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作正确的是( )
A、酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B、 锥形瓶用蒸馏水洗净后,再用未知浓度的NaOH待测液荡洗2~3次
C、 滴定前没有排除滴定管尖嘴处的气泡
D、读数时视线与滴定管内液体的凹液面最低处保持水平
1、下列是实验操作中,能达到实验目的是( )
A、用100mL量筒量取5.2mL盐酸
B、 用托盘天平称取25.20g氯化钠
C、 用100mL容量瓶配制50mL 0.1mol·L-1盐酸
D、用25.00mL碱式滴定管量取14.80mL NaOH溶液
4.实战演练
以一元酸和一元碱的中的滴定为例
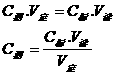
因C标、V定分别代表标准液浓度、所取待测液体积,均为定值,代入上式计算。
但是实际中C标、V定都可能引起误差,一般可把各因素引起的误差转嫁到V读上,若
V读偏大,则测定结果偏大;若V读偏小,则测定结果偏小,故通过分析V读的变化情况,可分析滴定的误差。
引起误差可能因素有以下几种:
(1)视(读数)










注意:①滴定管中液体读数时精确到0.01mL
②一般需滴定2-3次,取其平均值
(2)洗(仪器洗涤)
正确洗法:
二管二洗--滴定管和移液管先用蒸馏水清洗多次,再用待装液润洗几次。
一瓶一洗--锥形瓶只能用蒸馏水洗。
注意:一般滴定管装标准液,锥形瓶里装待测液。
错误洗法导致结果:
①滴定管仅用水洗,使标准液变稀,故消耗标准液体积一定变大,V读变大,结果偏大。
②移液管仅用水洗,则待测液变稀,所取待测液溶质物质的量变少,V读变小,结果偏小。
③锥形瓶用待测液洗过,则瓶内待测液的溶质量偏多,V读偏大,结果偏大。
④第一次滴定完后,锥形瓶内液体倒去后,尚未清洗,接着第二次滴定,滴定结果如何,取决于上次滴定情况如何。
(3)漏(液体溅漏)
①滴定过程中锥形瓶内液体溅出,则结果偏小。
②终点已到,滴定管下端尖中级有液滴,则V读偏大,测定结果偏大。
(4)泡(滴定管尖嘴气泡)
正确操作应在滴定前把尖嘴管中的气泡赶尽,最后也不能出现气泡。如滴定开始有气泡,后气泡消失,则结果偏大。若先无气泡,后有气泡,则结果偏小。
(5)色(指示剂变色控制与选择)
滴定时,眼睛应紧盯着锥形瓶内溶液的颜色变化。指示剂变色后应半分钟内不复原。如变色后立即复原,则结果偏小。另外,同一种滴定,选择的指示剂不同,测定结果不同。
(6)杂(标准物含杂)
用于配制标准液的固体应该是纯净物。但其中有可能混有杂质,称量时又按需标准物固体质量来称取的,帮一般均会产生误差,在此杂质又分两种情况:
①杂质与待测液不反应
如NaOH中含NaCl,所配的NaOH溶液浓度变小,滴定盐酸时,NaCl不参与反应,所需标准液的体积偏大,故测定结果偏大。
②若杂质与待测液反应,则应作具体分析。关键:比较与等物质的量的待测物反应消耗的杂质质量和标准物的质量。若消耗杂质的质量较大,则相当于削弱了原标准液的作用能力,故与一定量待测物反应时,消耗的标准体积变大,测定结果偏大。
或者可用等质量的杂质、标准物分别与待测物反应,根据消耗的待测物质量的多少来判断。如杂质作用待测物质量越多,说明作用能力被增强,故测定结果偏小。
3.例题精讲
例1:图示为10mL一定物质的量浓度的盐酸x,用一定浓度的NaOH溶液y滴定。根据图示推出x和y的物质的量浓度是( )
|
|
A |
B |
C |
D |
|
X浓度(mol/L) |
0.12 |
0.04 |
0.03 |
0.09 |
|
Y浓度(mol/L) |
0.04 |
0.12 |
0.09 |
0.03 |
PH值




 解析:(1)x
10ml、y 30ml时恰好中。
解析:(1)x
10ml、y 30ml时恰好中。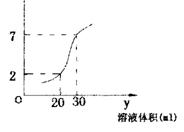
30y-10x 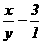 .
A、B合适
.
A、B合适
(2)加入y 20ml时,PH=2 代入
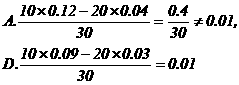 PH=2
PH=2
∴选 D。
例2.用0.01 mol/L H2SO4滴定0.01mol/L NaOH溶液,中和后加水至100ml,若滴定时终点判断有误差:①多加1滴H2SO4;②少加1滴H2SO4;(设1滴为0.05ml)则①和②[H+]的比值是( )
A、10 B、50 C、5×103 D、104
解析:①多一滴H2SO4[H+]=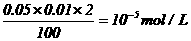
②少一滴即OH过量,[OH-]=10-5 mol/L.[H+]=10-9 mol/L
① 与②[H+]比值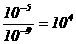 。故选D。
。故选D。
例3:草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
称取Wg草酸晶体,配成100.00mL水溶液
(1)称25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答:(1)实验中不需要的仪器有(填序号)___________,还缺少的仪器有(填名称)___________________________________________________________________________。
a.托盘天平(带砝码,镊子)b.滴定管 c.100mL量筒 d.100mL容量瓶 e.烧杯
f.漏斗 g.锥形瓶 h.玻璃棒球 i.药匙 j.烧瓶
(2)实验中,标准液KMnO4溶液应装在_____________________式滴定管中,因为______________________________________________________________________。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,
则所测得的x值会__________________________(偏大、偏小、无影响)
(4)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的
量浓度为________________________mol·L-1,由此可计算x的值是____________。
解析:该题涉及到气化还原滴定,虽然基于反应原理与中和滴定不同,但实验原理及操作和所用仪器等类似。由于该反应有明显的颜色变化,故可不可用指示剂。
(1)c , f , j
还缺少铁架台(带滴定管夹),胶头滴管(定容时用)
(2)用酸式滴定管,因KMnO4溶液有强氧化性,能腐蚀橡皮管。
(3)无影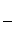 响。因当初所取的待测液的物质的量一定。
响。因当初所取的待测液的物质的量一定。
(4) 2KMnO4 ~ 5H2C2O4
2mol 5mol
aV×10-3mol 0.025×Cmol
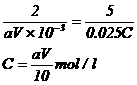
H2C2O4·xH2O ~ H2C2O4 ~ xH2O
1mol 18xg

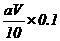
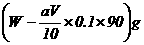
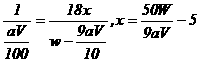
2、酸碱指示剂
(1)酸碱指示剂的变色范围(PH值)
|
甲基 |
3.1< |
3.1~4.4 |
>4.4 |
|
红 |
橙 |
黄 |
|
|
酚酞 |
5< |
8~10 |
>10 |
|
无色 |
浅红 |
红 |
|
|
石蕊 |
8< |
5~8 |
>8 |
|
红 |
紫 |
蓝 |
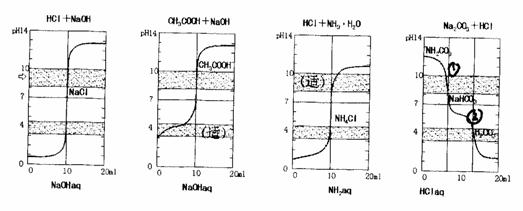
(2)根据滴定曲线和指示剂的发色范围选用指示剂。
从上面滴定曲线图可依次看出
①0.1mol/L NaOH 滴定盐酸,酚酞和甲基均可使用,当然两者测定结果不同。
②0.1mol/L NaOH溶液滴定0.1mol/L CH3COOH溶液
恰好中和生成CH3COOCa,溶液呈弱碱性,选酚酞为指示剂,PH=8~10浅红色,误差小。
③用HCl滴定NH3.H2O
恰好中和生成NH4Cl,溶液呈弱酸性,选甲基橙为指示剂,3.1~4.4橙色,误差小。
④用HCl滴定0.1mol/L Na2CO3溶液
第一步生成N aHCO3时,可选用酚酞为指示剂,由红色→浅红→无色。化学方程式为:
Na2CO3+HCl===NaHCO3+NaOH
第二步生成碳酸(CO2↑+H2O),可选用甲基橙为指示剂,由黄色→橙色,化学方程式为:NaHCO3+HCl===NaCl+H2O+CO2↑
小 结:
(1)指示剂的选择:(由滴定曲线可知)
①强酸强碱相互滴定,可选用甲基橙或酚酞。
②若反应生成强酸弱碱盐溶液呈酸性,则选用酸性变色范围的指示剂(甲基橙);若反应生成强碱弱酸盐,溶液呈碱性,则选用碱性变色范围的指示剂(酚酞)
③石蕊试液因颜色变化不明显,且变色范围过宽,一般不作滴定指示剂。
(2)终点判断:(滴入最后一滴,溶液变色后,半分钟内不复原)
|
指示剂 操 作 |
酚酞 |
甲基橙 |
|
强碱滴定强酸 |
无色变为浅红色 |
橙色变为黄色 |
|
强酸滴定强碱 |
浅红色变为无色 |
黄色变为橙色 |
随着标准液的滴入,溶液的PH在发生变化,这种变化有何特征?为何能用指示剂判定终点是否到达?如何选用合适的指示剂?
1、滴定曲线
请看两个实例
实例1:用0.10mol/L NaOH溶液滴定0.10mol/L HCl溶液20.00mL
|
加入的VNaOH (mL) |
余VHCl (mL) |
过量VNaOH (mL) |
PH |
|
0.00 |
20.00 |
|
1.0 |
|
18.00 |
2.00 |
|
2.3 |
|
19.80 |
0.20 |
|
3.3 |
|
19.98 |
0.02 |
|
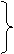 4.3 4.3 |
|
20.00 |
0.00 |
|
7.0 突跃范围 |
|
20.02 |
|
0.02 |
9.7 |
|
20.20 |
|
0.20 |
10.7 |
|
22.00 |
|
2.00 |
11.7 |
|
40.00 |
|
20.00 |
12.5 |
实例2:用0.01mol/L NaOH滴定20mL 0.10mol/L CH3COOH溶液
|
加入的VNaOH (mL) |
余VHCl (mL) |
过量VNaOH (mL) |
PH |
|
0.00 |
20.00 |
|
2.9 |
|
18.00 |
2.00 |
|
5.7 |
|
19.80 |
0.20 |
|
6.7 |
|
19.98 |
0.02 |
|
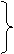 7.7 7.7 |
|
20.00 |
0.00 |
|
8.7 突跃范围 |
|
20.02 |
|
0.02 |
9.7 |
|
20.20 |
|
0.20 |
10.7 |
|
22.00 |
|
2.00 |
11.7 |
|
40.00 |
|
20.00 |
12.6 |
由上表数据可看出:在滴定接近终点时,少加或多加0.02mL NaOH溶液,即一滴之差造成的误差在允许范围内,但pH值出现突变,因此选择指示剂时,应选择变色范围与滴定时pH值突跃范围相吻合的指示剂。
现将几种典型的滴定曲线画出如下图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com