
题目列表(包括答案和解析)
1.判断或解释盐溶液的酸碱性
例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分别为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________
②相同条件下,测得①NaHCO3 ②CH3COONa ③NaAlO2三种溶液的pH值相同。那实验么它们的物质的量浓度由大到小的顺序是_______________.
因为电离程度CH3COOH>HAlO2所以水解程度NaAlO2>NaHCO3>CH3COON2在相同条件下,要使三种溶液pH值相同,只有浓度②>①>③
 HA H++A--Q A-+H2O HA+OH--Q
HA H++A--Q A-+H2O HA+OH--Q
温度(T)T↑→α↑ T↑→h↑
加水 平衡正移,α↑ 促进水解,h↑
增大[H+] 抑制电离,α↑ 促进水解,h↑
增大[OH-]促进电离,α↑ 抑制水解,h↑
增大[A-] 抑制电离,α↑ 水解程度,h↑
注:α-电离程度 h-水解程度
思考:①弱酸的电离和弱酸根离子的水解互为可逆吗?
②在CH3COOH和CH3COONO2的溶液中分别加入少量冰醋酸,对CH3COOH电离程度 和CH3COO-水解程度各有何影响?
内因:盐的本性.
外因:浓度、湿度、溶液碱性的变化
(1)温度不变,浓度越小,水解程度越大.
(2)浓度不变,湿度越高,水解程度 越大.
(3)改变溶液的pH值,可抑制或促进水解。
2.酸式盐
①若只有电离而无水解,则呈酸性(如NaHSO4)
②若既有电离又有水解,取决于两者相对大小
电离程度>水解程度,呈酸性
电离程度<水解程度,呈碱性
强碱弱酸式盐的电离和水解.
a) 以HmAn-表示弱酸酸式盐阴离子的电离和水解平衡.

Hm+1A(n-1)-+OH- HmAn-1 + H2O Hm-1A(n+1)-+ H+
抑制水解 抑制电离
增大[OH-] 促进电离 促进水离 [H+]增大
仅能存在于一定pH值范围
如H3PO4及其三种阴离子随溶液pH变化可相互转化:
pH值增大
 H3PO4 H2PO4- HPO42- PO43-
H3PO4 H2PO4- HPO42- PO43-
pH减小
③常见酸式盐溶液的酸碱性
碱性:NaHCO3、NaHS、Na2HPO4、NaHS.
酸性:NaHSO3、NaH2PO4、NaHSO4
简述为:有弱才水解,无弱不水解
越弱越水解,弱弱都水解
谁强显谁性,等强显中性
具体为:
1.正盐溶液
①强酸弱碱盐呈酸性
②强碱弱酸盐呈碱性
③强酸强碱盐呈中性
④弱酸碱盐不一定
如 NH4CN CH3CO2NH4 NH4F
碱性 中性 酸性
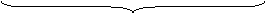
取决于弱酸弱碱 相对强弱
H2O H++OH-
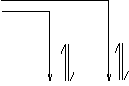
AB== Bn- + An+
HB(n-1)- A(OH)n
当盐AB能电离出弱酸阴离子(Bn-)或弱碱阳离子(An+),即可与水电离出的H+或OH-结合成电解质分子,从而促进水进一步电离.
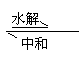 与中和反应的关系:
与中和反应的关系:
盐+水 酸+碱(两者至少有一为弱)
由此可知,盐的水解为中和反应的逆反应,但一般认为中和反应程度大,大多认为是完全以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
20、称取NaOH、Na2CO3的混合物Wg,溶于水中,加入酚酞作指示剂,以Mmol/L的盐酸滴定,耗用V1L时变为粉红色,此时发生的化学反应方程式是_________________________
__________________________________________________________________;若最初以甲基橙作指示剂,当耗用V2L盐酸时变橙色,此时发生的化学反应方程_______________________
______________________________________________由此计算混合物中NaOH和Na2CO3的质量分数分别为多少?
19、某学生有0.1000mol/L KOH溶液滴定未知尝试的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)实验中用左手控制____________(填仪器及部位),眼睛注视____________________,直至滴定终点。判断到达终点的现象是________________________________________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并有来滴定上述盐酸,则对测定结果的影响是___________________________________________________-。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是______________。
18、用中和滴定的方法测定NaOH和Na2CO3的混含液中的NaOH含量时,可先在混合液中加过量BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示)
(1)向混有BaCO3沉淀的NaOH和NaOH溶液中滴入盐酸,___________(填“会”或“不会”)使BaCO3溶解而影响测定NaOH的含量,理由是________________。
(2)确定终点时溶液的颜色由___________变为_____________。
(3)滴定时,若滴定这中滴定液一直下降到活塞处才到达滴定终点,_________(填“能”或“不能”)由此得出准确的测定结果。
(4)___________(填“能”或“不能”)改用甲基橙作指示剂。若使用甲基橙作指示剂,则测定结果_____________(填“偏高”、“偏低”或“正确”)。
17、(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中液体的体积是___________________mL。(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)______________。
A、是amL
B、 是(50-a)mL
C、 一定大于amL
D、一定大于(50-a)mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com