
题目列表(包括答案和解析)
4.实战演练
一 选择题
3.例题精讲
知识点一:水的电离
[例1](1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 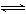 NH4++NH2-
NH4++NH2-
据此判断以下叙述中错误的是 ( )
A.液氨中含有NH3、NH4+、NH2-等微粒
B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数
C.液氨的电离达到平衡时C(NH3) = C(NH4+) = C(NH2-)
D.只要不加入其他物质,液氨中C(NH4+) = C(NH2-)
(2)完成下列反应方程式
①在液氨中投入一小块金属钠,放出气体----------------------------
②NaNH2溶于水的反应----------------------------------
③类似于“H++OH-=H2O”的反应----------------------------
解析:此题要求掌握水自偶的实质(水分子电离产生的H+与H2O结合形成H3O+)以及水的电离平衡,并能迁移应用于对于NH3电离的认识:NH3分子电离产生H+和NH2-,H+与NH3结合生成NH4+,液氨电离产生等量的NH2-与NH4+,一定温度下离子浓度乘积为一常数;NH4+类似于H+,NH2-类似于OH-。具备上述知识后,就可顺利完成解题。
答案:(1)C
(2)①2Na+2NH3=H2↑+2NaNH2
②NaNH2+H2O=NaOH+NH3↑或NH2-+H2O=OH-+NH3↑
③NH2-+NH4+ =2NH3↑或NH4Cl+NaNH2=2NH3↑+NaCl
知识点二:水的离子积
[例2]某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C(OH-) = ___________。
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = ___________。
解析:由水电离产生的H+与OH-量始终相等,知纯水中C(H+) = C(OH-)。根据纯水中C(H+) 与C(OH-)可求出此温度下水的Kw的值,由Kw的性质(只与温度有关,与离子浓度无关),若温度不变,稀盐酸中Kw仍为此值,利用此值可求出盐酸中的C(OH-)。
答案:纯水中 C(OH-) = C(H+) = 2×10-7 mol/L
Kw = C(H+)·C(OH-) = 2×10-7×2×10-7 = 4×10-14
稀盐酸中 C(OH-) = Kw / C(H+) = (4×10-14) / (5×10-6) = 8×10-9 mol/L
[例3] .难溶化合物的饱和溶液存在着溶解平衡,例如:
AgCl(s) 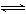 Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s) 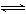 2Ag++CrO42-,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42-中哪种先沉淀?
2Ag++CrO42-,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42-中哪种先沉淀?
(2)当CrO42-以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少? CrO42-与Cl-能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
解析:(1)当溶液中某物质离子浓度的乘积大于Ksp时,会形成沉淀。几种离子共同沉淀某种离子时,根据各离子积计算出所需的离子浓度越小越容易沉淀。(2)由Ag2CrO4沉淀时所需Ag+浓度求出此时溶液中Cl-的浓度可判断是否达到有效分离。
解答:(1)AgCl饱和所需
Ag+浓度[Ag+]1=1.8×10-7摩/升
Ag2CrO4饱和所需Ag+浓度[Ag+]2=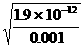 =4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时[Cl-]=
=4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时[Cl-]=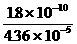 =4.13×10-6<10-5,所以能有效地分离。
=4.13×10-6<10-5,所以能有效地分离。
知识点三:水的电离平衡的移动
[例4] :某溶液中由水电离出来的C(OH-)=10-12mol/L,则该溶液中的溶质不可能是( )
A、HCl B、NaOH C、NH4Cl D、H2SO4
解析:由水电离反应式知:此溶液水电离产生的C(H+)=C(OH-) =10-12mol/L,若溶液中的H+全部来自水的电离,则此溶液显碱性,是因溶有碱类物质所致,若溶液中的H+不仅为水电离所产生,则此溶液显酸性,为酸性物质电离所致。NH4Cl不可能电离产生H+。
解答:C
下列两题为上题的变式,分析一下变在何处?解题方法、思路与上题是否一样?差异何在?
(1)室温下,在纯水中加入某物质后,测得溶液中由水电离产生的C(H+)=10-12mol/L,则加入的物质可能是(假设常温下碳酸、氢硫酸的第一步电离度为0.1%) ( )
A、通入CO2 B、通入H2S C、通入NH3 D、加入NaHSO4
(2)某溶液中水电离产生的C(H+)=10-3mol/L,,该溶液中溶质可能是( )
①Al2(SO4)3 ②NaOH ③NH4Cl ④NaHSO4
A、①② B、①③ C、②③ D、①④
[例5]能促进水的电离,并使溶液中C(H+)>C(OH-)的操作是 ( )
(1)将水加热煮沸 (2)向水中投入一小块金属钠 (3)向水中通CO2 (4)向水中通NH3 (5)向水中加入明矾晶体 (6)向水中加入NaHCO3固体 (7)向水中加NaHSO4固体
A、(1)(3)(6)(7) B、(1)(3)(6) C、(5)(7) D、(5)
解析:本题主要考查外界条件对水的电离平衡的影响,请按如下思路完成本题的解:本题涉及到哪些条件对水的电离平衡的影响?各自对水的电离平衡如何影响?结果任何(C(H+)与C(OH-)相对大小)?归纳酸、碱、盐对水的电离平衡的影响。
解答: D
知识点四:pH的定义方法
[例6]、下列溶液,一定呈中性的是 ( )
A.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
B.[H+]=1×10-7mol·L-1的溶液
C.pH=14-pOH 的溶液
D.pH=pOH 的溶液 (2000年化学试测题)
解析:此题要求将教材中定义pH方法迁移应用于表示pOH以及pH与pOH的关系,根据pH的定义方法,可定义pOH= ―lgC(OH―),将室温下水的离子积的表达式C(H+)×C(OH-)=10―14两边取负对数,―lgC(H+)―lgC(OH―)= ―lg10―14,整理得pH+pOH=14。应用所得关系式分析可得答案。
解答:D
点评:pOH= ―lgC(OH―)、pH+pOH=14两个关系式及其应用均不在教学大纲和考纲范围内,我们不一定要掌握,但将教材中的知识、方法加以迁移应用,进行探究发现是教学大纲和考纲提出的能力要求。此题作为全国高考化学测试题具有重要的指导意义,值得大家认真去领悟,在随后的2001年上海高考题以及2002年全国理科综合高考题中又出现了类似的题目。
为更好地表示溶液的酸碱性,科学 家提出了酸度(AG)的概念,AG=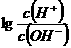 ,则下列叙述正确的是
,则下列叙述正确的是
A 中性溶液的AG=0
B 酸性溶液的AG<0
C 常温下0.lmol/L氢氧化钠溶液的AG=12
D 常温下0.lmol/L盐酸溶液的AG=12( 2001年上海)
有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为AG=lg([H+]/[OH-])。下列表述正确的是
A 在25℃时,若溶液呈中性,则pH=7,AG=1
B 在25℃时,若溶液呈酸性,则pH<7,AG<0
C 在25℃时,若溶液呈碱性,则pH>7,AG>0
D 在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH) (2002理科综合)
知识点五:溶液pH的计算
[例7]室温下将n体积pH=10和m体积pH=13两种NaOH溶液混合得pH=12的NaOH溶液,则n:m=--------------
解析:此题是关于两种不反应的溶液混合后溶液pH值的计算,根据混合前后溶质(NaOH)量守恒,列式求解
解答:pH=10 C(H+)=10-10mol/L C(OH-) =10-4mol/L
pH=13 C(H+)=10-13mol/L C(OH-) =10-1mol/L
pH=12 C(H+)=10-12mol/L C(OH-) =10-2mol/L
10-4·n + 10-1·m = (n+m) ×10-2
n :m = 100 :11
规律: 有关混合溶液的pH计算,题设条件可千变万化,正向、逆向思维,数字与字母交替出现,但基本题型只有两种:(1)混合后不反应,(2)混合后反应。对于溶液的稀释,可将水作为浓度为0的溶液,仍属混合后不反应一类,这一类混合溶液的pH应介于两种溶液的pH之间,因而酸、碱溶液无论加多少水稀释,其最终pH均不可能等于纯水的pH(即常温不可能为7)。
混合溶液pH的计算方法也很简单,即设法求出混合溶液的C(H+),若是溶液显碱性,则必须先求出溶液的C(OH-),然后再换算为C(H+)或按OH-量守恒列式求解。
[例8]25ºC,若10体积的某强碱溶液与1体积的某强酸溶液混合后,溶液呈中性,则混合之前,该碱的pH与强酸的pH之间该满足的关系是_______________________
分析:由题意知,本题为酸、碱混合后完全中和,根据中和反应的实质可知,酸中n(H+)与碱中n(OH-)相等,故有C(H+)酸V酸 == C(OH-)碱V碱,由此关系列式可求得结果。
解答:设酸的pH为a,C(H+)酸=10-a,碱的pH为b,C(OH-)碱=10-14 / 10-b=10- (14 - b)
因为混合后溶液呈中性,所以C(H+)酸V酸 == C(OH-)碱V碱
10-a ×V = 10 - (14 - b) ×10V = 10 - (13 - b) ×V
10-a = 10 - (13 - b)
两边取负对数:-lg10-a = -lg10 - (13 - b),a=13-b a+b=13
即酸的pH与碱的pH之和为13
点评:上面解法尽管可顺利地得出本题的解,但题中的酸碱体积比可以任意变换,则每一变换都得重新求解,这就启发我们能否找出酸、碱pH与两者体积比之间的关系呢?同时若混合后不显中性其关系又会怎样呢?
将上面的解改为:
C(H+)酸V酸 == C(OH-)碱V碱
10-a ×V酸 = 10 - (14 - b) ×V碱
10-a·10-b=10-14·(V碱 / V酸)
两边取负对数得:a+b=14―lg(V碱 / V酸)
若混合后溶液显酸性------------------------:
若混合后溶液显碱性-------------------------:
同学们在学习中要善于总结、积累,把自己积累的经验、成果用于指导自己的学习。例如掌握了上述关系后,解下列题目就很轻松。
在20℃时,有PH值为x(x£6)的盐酸和PH值为y(y³8)的NaOH溶液,取Vx升该盐酸同该NaOH溶液中和,需Vy升NaOH溶液
(1)若x+y=14时,则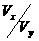 =
(2)若x+y=13时,则
=
(2)若x+y=13时,则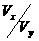 =
(3)若x+y>14时,则
=
(3)若x+y>14时,则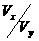 =
(表达式),且Vx Vy(填<、>或=)
=
(表达式),且Vx Vy(填<、>或=)
3.关于酸、碱混合时的定性判断(常温)
酸与碱混合时发生中和反应,但不一定恰好完呈中和。即使恰好完全中和,也不一定溶液呈中性,由生成的盐能否水解及水解情况而定,另外酸碱的强弱不同,提供反应物的量不同也影响着反应后溶液的性质。一般酸或碱过量化生成的盐水解对溶液的酸碱性影响大。
下面把常见的几种情况分列出来.
①等物质的量浓度的一元弱酸一元强碱溶液等体积混合溶液pH>7(由生成的强碱弱酸盐水解决定)
②等物质的量浓度的一元强酸与一元弱碱溶液等体积混合后溶液pH<7(由生成的强酸弱碱盐水解决定)
③等物质的量浓度的一元强酸与强碱溶液等体积混合后溶液pH=7(因生成强酸强碱盐不水解)
想一想:若酸或碱之一是多元,情况又怎样?
④当pH=pOH的强酸与强碱溶液以等体积混合后pH=7(与酸、碱的几元性无尖)
⑤当pH=3的某一元酸溶液与pH=11的一元强碱以等体积混合后pH≤7。(考虑酸有强弱之分,若分弱酸,制反应后酸过量)
⑥当pH=3的某一元强酸pH=11的一元碱溶液的以等体积混合后pH≥7(同理⑤,弱碱过量)
⑦将pH=3的酸溶液和pH=11的碱溶液以等体积混合后溶液pH=无法确定.
再想一想:⑤⑥⑦与酸、碱的几元性有无关系?
2.强酸和强碱混合(发生中和反应,忽略体积变化)可能情况有三种:
①若酸和碱恰好中和. 即nH+=nOH-,pH=7.
②若酸过量,求出过量的[H+],再求pH值.
③若碱过量,求出过量的[OH-],求出pOH后求pH值.
特例:若强酸与强碱等体积混合
①若pH酸+pH碱=14,则完全中和pH=7.
②若pH酸+pH碱>14,则碱过量pH≈pH碱-0.3
③若pH酸+pH碱<14,则酸过量pH≈pH酸+0.3
讨论:
pH=a的HCl溶液和pH=b的NaOH溶液按体积比V1 :V2混合.当混合液分别呈中性、酸性、碱性时,且V1 :V2=10n时,a+b分别为多少?
分析 ①呈中性:即pH=7.
nH+=nOH-
10-a·V1=10-(14-b)·V2
V1 :V2=10-14+a+b
10n=10a+b-14
n=a+b-14
a+b=14+n
②若呈酸性. 即pH<7
nH+>nOH-
10-a·V1>10-(14-b)·V2
V1 :V2>10-14+a+b
10n>10-14+ a+b
a+b<14+n
③若呈碱性,即pH>7,同理可知
a+b>14+n
想一想:若V1 :V2=1 :10n=10-n,三种情况的结果又如何呢?
1.溶液简单混合(不发生反应,忽略混合时体积变化)
 强酸:pH=pH小+0.3
强酸:pH=pH小+0.3
若等体积混合,且△pH≥2
强碱:pH=pH大-0.3
若不等体积混合,物质的量浓度 强酸[H+]总=
分别为M1、M2体积分别为 强碱[OH-]总=
V1、V2的一元强酸或强碱
注意:强酸直接由[H+]总求pH值
强碱由[OH-]总求pOH,后再求pH值.
由于强酸或强碱在水中完全电离,加水稀释后不会有溶质进一步电离,故仅仅是体积增大的因素导致酸溶液中的[H+]或碱溶液中的[OH-]减小.
弱酸或弱碱由于在水中不完全电离,加水稀释同时,能促使其分子进一步电离,故导致相应[H+]或[OH-]减小的幅度降低。
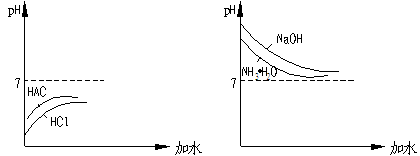
例如 ①等物质的量浓度的盐酸和醋酸,氢氧化钠和氨水分别加水稀释。溶液的pH值变化,图示如下:
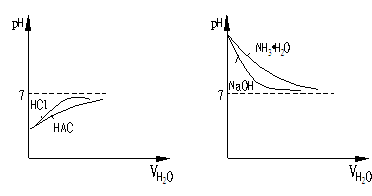
②若把上述问题,换成等pH值,图示又怎样呢?
强酸弱酸稀释 强、弱碱稀释
前 后
前
后
前 后
后
pH=a pH(HCl)=a+n<7 pH=b Ph(NaOH)=b-n>7
pH(HAC)<a+n<7 pH(NH3·H2C)>b-n>7
△pH(HCl)=n △pH(NaOH)=n
△pH(HAC)<n △pH(NH3·H2O)<n
△pH(HCl)>△pH(HAC) △pH(NaOH)>△pH(NH3·H2O)
注意:
①酸无论怎样稀释,不可能成为碱性;若无限稀释,则pH只能无限接近7且小于7.
②碱无论怎样稀释,不可能成为酸性;若无限稀释,则pH只能无限接近7且大于7
③当起始强酸、弱酸的pH相同,稀释后为达仍相同,则稀释倍数一定是弱酸大小强酸(强碱、弱碱类同)
溶液呈的酸碱性何性,取决于溶液中[H+]、[OH-]的相对大小:pH值的大小取决于溶液中的[H+]大小
pH=-lg[H+],pOH=-lgKw=pKw
|
溶液酸碱性 |
[H+]与[OH-]关系 |
||
|
任意湿度 |
室温(mol/L) |
pH值(室温) |
|
|
酸性 |
[H+]>[OH-] |
[H+]>1×10-7 |
<7 |
|
中性 |
[H+]=[OH-] |
[H+]=[OH-]=1×10-7 |
=7 |
|
碱性 |
[H+]<[OH-] |
[H+]>1×与10-7 |
>7 |
(1)酸性越强,pH值越小,碱性越强,pH值越大,pH值减小一个单位,[H+]就增大到原来的10倍,pH值减小n个单位,[H+]的增大到原来的10n倍.
(2)任意水溶液中[H+]≠0,但pH可为0,此时[H+]=1mol/L,一般[H+]>1mol/L时,pH<0,故直接用[H+]表示.
(3)判断溶液呈中性的依据为:[H0]= [OH-]或pH=pOH=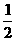 pKw
pKw
只有当室温时,Kw=1×10-14
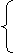 [H+]=[OH-]=10-7mol/L
[H+]=[OH-]=10-7mol/L
溶液呈中性
pH=pOH=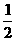 pKw=7
pKw=7
 分析 原因:H2O H++OH-Q
分析 原因:H2O H++OH-Q
由于水的电离是吸热的,湿度越高,电离程度越大,kw越大.
中性:pH=pOH=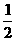 pKw
pKw
T↗→Kw↗→pH+pOH↘
T↘→Kw↘→pH=pOH↗
如:100℃,KW=1×10-12.. pKw=12.
中性时Ph=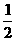 pKw=6<7.
pKw=6<7.
图示:不同湿度(T1>T2)时溶液中[H+]与[OH-],pH与pOH关系
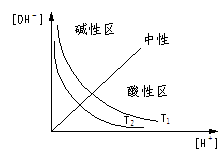
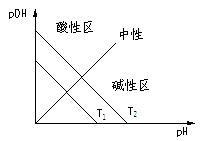
图一 图二
想一想:图一与图二有哪些不同?为何不同?
提示:(①形状 ②T1、T2相对位置)
③简平分钱划分的两个区域酸碱性不同。建议以[H+]、[OH-]=Kw,和pH+pOH=pKw两个关系或考虑,并注意湿度不同时Kw的影响。)
(4)溶液pH的测定方法:
①酸碱指示剂 ②pH试纸 ③pH计其中①只传判定pH范围
②pH试纸也只能确定在某个值左右(对照标准比色卡),无法精确到小数点后1倍。另外使用时不能预先润湿试纸。否则相当于又稀释了待测液,测定结果误差大。
③pH计测定较精确.
4.溶液中各种微粒浓度之间的关系
以Na2S水溶液为例来研究
(1)写出溶液中的各种微粒
阳离子:Na+、H+
阴离子:S2-、HS-、OH-
(2)利用守恒原理列出相关方程.
10电荷守恒:
[Na+]+[H+]=2[S2-]+[HS-]+[OH-]
20物料守恒:
Na2S=2Na++S2-
若S2-已发生部分水解,S原子以三种微粒存在于溶液中。[S2-]、[HS-],根据S原子守恒及Na+的关系可得.
[Na+]=2[S2-]+2[HS-]+2[H2S]
30质子守恒
 H2O H++OH-
H2O H++OH-
由H2O电离出的[H+]=[OH-],水电离出的H+部分被S2-结合成为HS-、H2S,根据H+(质子)守恒,可得方程:
[OH-]=[H+]+[HS-]+2[H2S]
想一想:若将Na2S改为NaHS溶液,三大守恒的关系式与Na2S对应的是否相同?为什么?
提示:由于两种溶液中微粒种类相同,所以阴、阳离子间的电荷守恒方程及质子守恒是一致的。但物料守恒方程不同,这与其盐的组成有关,若NaHS只考虑盐本身的电离而不考虑HS-的进一步电离和水解,则[Na+]=[HS-],但不考虑是不合理的。正确的关系为[Na+]=[HS-]+[S2-]+[H2S]
小结:溶液中的几个守恒关系
(1)电荷守恒:电解质溶液呈电中性,即所有阳离子所带的正电荷总数与所有阴离子所带的负电荷总数代数和为零。
(2)物料守恒(原子守恒):即某种原子在变化过程(水解、电离)中数目不变。
(3)质子守恒:即在纯水中加入电解质,最后溶液中[H+]与其它微粒浓度之间的关系式(由电荷守恒及质子守恒推出)
练一练!
写出0.1mol/L Na2CO3溶液中微粒向后三天守恒关系式。
3.比较盐溶液中离子浓度间的大小关系.
(1)一种盐溶液中各种离子浓度相对大小
①当盐中阴、阳离子等价时
[不水解离子] >[水解的离子] >[水解后呈某性的离子(如H+或OH-)] >[显性对应离子如OH-或H+]
实例:aCH3COONa. bNH4Cl
a.[Na+]>[CH3COO-] >[OH-] >[H+]
b.[Cl-] >[NH4+]>[OH-]
②当盐中阴、阳离子不等价时。
要考虑是否水解,水解分几步,如多元弱酸根的水解,则是“几价分几步,为主第一步”,实例Na2S水解分二步
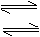 S2-+H2O HS-+OH-(主要)
S2-+H2O HS-+OH-(主要)
HS-+H2O H2S+OH-(次要)
各种离子浓度大小顺序为:
[Na+]>[S2-] >[OH-] >[HS-] >[H+]
(2)两种电解质溶液混合后各种离子浓度的相对大小.
①若酸与碱恰好完全以应,则相当于一种盐溶液.
②若酸与碱反应后尚有弱酸或弱碱剩余,则一般弱电解质的电离程度>盐的水解程度.
2.分析盐溶液中微粒种类.
例如 Na2S和NaHS溶液溶液含有的微粒种类相同,它们是Na+、S2-、HS-、H2S、OH-、H+、H2O,但微粒浓度大小关系不同.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com