
题目列表(包括答案和解析)
2.对于可逆反应:N2(g) + 3H2(g) 
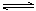 2NH3(g) (正反应为放热反应)。下列说法中正确的是
( )
2NH3(g) (正反应为放热反应)。下列说法中正确的是
( )
A.达到平衡时,NH3的生成速率等于NH3的分解速率
B.达到平衡时,反应物和生成物的浓度一定相等
C.达到平衡时,若加入N2,在重新达平衡时,NH3的浓度比原平衡时增大,H2的浓度比原平衡时减小
D.达到平衡时,若升高温度,加快了吸热反应的速率,降低了放热反应的速率,所以平衡向逆反应方向移动
1.下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是 ( )
A.使用铁触媒,使N2和H2混合气体有利于合成氨
B.高压比低压条件更有利于合成氨的反应
C.500℃左右比室温更有利于合成氨的反应
D.合成氨时采用循环操作,可提高原料的利用率
15.(6分)为测定人呼出气体中二氧化碳的含量,将1000 mL呼出的气体通入50.0 mL氢氧化钡溶液中,使其完全吸收,过滤后取20.0 mL澄清溶液,用0.100 mol·L-1盐酸滴定,当耗去20.4 mL盐酸时恰好完全反应。另取20.0 mL原氢氧化钡溶液,用同种盐酸滴定,耗去36.4 mL盐酸时,恰好反应完全。试计算人呼出气体中二氧化碳的体积百分含量(气体体积在标准状况下测定)。
14.(8分)在a、b两支试管中,分别装上形态相同、质量相等的一颗锌粒,然后向两支试管中分别加入相同物质的量、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中的现象:相同点是 ;不同点是 。原因是 。
(2)a、b两支试管中生成气体的体积开始时是a 于b,反应完毕后生成气体的总体积是a b,原因是 。
13.(8分)在稀氨水中存在平衡:NH3+H2O NH
NH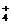 +OH-,如进行下列操作,则NH3、NH
+OH-,如进行下列操作,则NH3、NH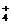 、H+、OH-浓度如何变化?试用“增大”“减小”“不变”填写。
、H+、OH-浓度如何变化?试用“增大”“减小”“不变”填写。
(1)通适量HCl气体时,c(NH3) ,c(H+) 。
(2)加入少量NaOH固体时,c(NH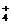 )
,c(OH-)
。
)
,c(OH-)
。
(3)加入NH4Cl晶体时,c(NH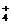 )
,c(OH-)
。
)
,c(OH-)
。
12.(12分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度大于第二步电离程度,第二步电离程度远大于第三步电离程度……
今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
①HA+HC2-(少量)===A-+H2C-
②H2B(少量)+2A-===B2-+2HA
③H2B(少量)+H2C-===HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是 。
(2)A-、B2-、C3-、HB-、H2C-、HC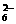 种离子中,最易结合质子的是
,最难结合质子的是
。
种离子中,最易结合质子的是
,最难结合质子的是
。
(3)判断下列反应的离子方程式中正确的是(填写标号) 。
A.H3C+3A-===3HA+C3-
B.HB-+A-===HA+B2-
C.H3C+B2-===HB-+H2C-
(4)完成下列反应的离子方程式。
A.H3C+OH-(过量) ;
B.HA(过量)+C3- 。
11.(9分)如下图,在一烧杯中盛有200 mL 0.1 mol·L-1的H3PO4溶液,同时一光滑小球悬浮在液体中间。
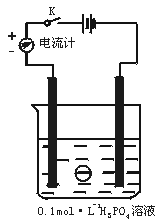
(1)合上电键K时,电流计指针向 边偏转。
(2)向烧杯里逐滴滴入0.4 mol·L-1的Ba(OH)2溶液至刚好完全反应,可观察到的现象有:
① ,② ,③ 。
(3)磷酸可用磷矿石[Ca3(PO4)2]来制取,写出该反应的化学方程式:
10.(12分)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol·L-1的溶液 100 mL;②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释为100 mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)。
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
a.装HCl溶液的试管中放出H2的速率快;
b.装HA溶液的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快:
(3)请你评价乙方案中难以实现之处和不妥之处。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
9.在RNH2·H2O RNH
RNH +OH-形成的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
+OH-形成的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
A.通入HCl B.加少量NaOH固体
C.加水 D.升温
8.当溶液中HS-+H2O S2-+H3O+达到平衡时,欲使c(S2-)增大,应加入
S2-+H3O+达到平衡时,欲使c(S2-)增大,应加入
A.Cu2+ B.CO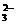
C.H2O D.HCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com