
题目列表(包括答案和解析)
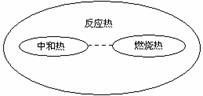 1、化学反应过程中放出或吸收的热量,通常叫做反应热。反应热用符号ΔH表示,单位一般采用kJ/mol。当ΔH为负值为放热反应;当ΔH为正值为吸热反应。测量反应热的仪器叫做量热计。
1、化学反应过程中放出或吸收的热量,通常叫做反应热。反应热用符号ΔH表示,单位一般采用kJ/mol。当ΔH为负值为放热反应;当ΔH为正值为吸热反应。测量反应热的仪器叫做量热计。
2、燃烧热:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时放出的热量,叫做该物质的燃烧热。
恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值。
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平)= 。
(4)原混合气体中,a∶b= 。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)= 。
2.在一定条件下,1molN2和3molH2混合后反应,达到平衡时测得平衡混合物的密度是同温同压下氢气的5倍,则氮气的转化率是 。若在同一个容器中,在相同的温度下,向容器中充入NH3,为使达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量为 。
1.一定温度下某密闭容器中进行反应:N2 +3H2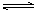 2NH3 ,达平衡后
2NH3 ,达平衡后
①保持容器体积一定,通入N2,平衡 移动。
②保持容器体积一定,通入Ar,平衡 移动。
③保持容器压强一定,通入Ar,平衡 移动。
④保持容器体积一定,通入N2、H2、NH3,使浓度都变为原来的2倍,平衡 移动。
8.合成氨所需的氢气由煤和水发生反应制得,其中一步反应为:
CO + H2O(g) 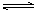 CO2 + H2(正反应为放热反应)。要使CO转化率提高,( )
CO2 + H2(正反应为放热反应)。要使CO转化率提高,( )
A.增大H2O(g)的浓度 B.增大CO的浓度
C.降低温度 D.增大压强
7.在N2 +3H2 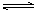 2NH3的平衡体系中,当分离出NH3时,下列说法中正确的是( )
2NH3的平衡体系中,当分离出NH3时,下列说法中正确的是( )
A.正反应速率增大 B.平衡向逆反应方向移动
C.正反应速率大于逆反应速率 D.逆反应速率先变小后变大
6.二氧化氮存在下列平衡:2NO2(g) 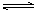 N2O4(g)(正反应为放热反应)。在测定NO2的相对分子质量时,下列条件中较为适宜的是
( )
N2O4(g)(正反应为放热反应)。在测定NO2的相对分子质量时,下列条件中较为适宜的是
( )
A、温度130℃、压强3.03×105Pa B、温度25℃、压强1.01×105Pa
C、温度130℃、压强5.05×104Pa D、温度0℃、压强5.05×104Pa
5.有平衡体系:CO(g)+2H2(g) 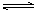 CH3OH(g)(正反应为放热反应),为了增加甲醇的产量,工厂应采取的正确措施是
( )
CH3OH(g)(正反应为放热反应),为了增加甲醇的产量,工厂应采取的正确措施是
( )
A.高温、高压 B.适宜温度、高压、催化剂
C.低温、低压 D.低温、高压、催化剂
4.将H2和N2的混合气体通入合成塔中,经过1个小时达到平衡,此时N2、H2、NH3的浓度分别为3、7、4(单位均为mol/L),则以下叙述正确的 ( )
①N2的反应速率为2mol/(L·h) ②H2的反应速率为7 mol/(L·h) ③H2的起始浓度为13mol/L④N2起始浓度为2 mol/L ⑤H2的转化率为46.2%
A.①② B.②⑤ C.①③⑤ D.②④
3.工业上合成氨时一般采用500℃左右的温度,其原因是 ( )
⑴适当提高氨的合成速率 ⑵提高H2的转化率
⑶提高氨的产率 ⑷催化剂在500℃时活性最大
A.只有⑴ B.⑴⑵ C.⑵⑶⑷ D.⑴⑷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com