
题目列表(包括答案和解析)
3.已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O △H=Q1kJ/mol
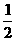 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=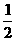 Na2SO4(aq)+H2O(1)
△H=Q2kJ/mol
Na2SO4(aq)+H2O(1)
△H=Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H=Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为 ( )
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
答案:B
2.含20.0NaOH的稀溶液与稀盐酸反应,放出28.7kJ的热量,表示该反应中和热的热化学方程式正确的是 ( )
A.1/2NaOH(aq)+1/2HCl(aq)=1/2NaCl(aq)+1/2H2O(l);ΔH=+28.7kJ/mol
B.1/2NaOH(aq)+1/2HCl(aq)=1/2NaCl(aq)+1/2H2O(l);ΔH=-28.7kJ/mol
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+57.4kJ/mol
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.4kJ/mol
答案:D
1.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是 ( )
A.氯化钠 B.固体硝酸铵 C.固体氢氧化钠 D.生石灰
答案:B
4.实战演练
化学反应中反应热的大小与反应物、生成物的种类、量及聚集状态有关,与反应途径无关。根据能量守恒定律,无论反应是一步完成还是几步完成,只要反应的起始状态和终了状态确定,反应热就是个定值,这就是著名的盖斯定律。
3.例题精讲
[例1]已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是 ( )
A.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
[解析]根据题目条件,生成的水为液态,所以A错,1gC8H18燃烧后放出热量48.40kJ,故1molC8H18完全燃烧放出热量5518kJ,放热用“-”表示,故C错。
[答案]B
[评析]热化学方程式的书写较难,书写时不能忽视反应物、生成物的状态,要注意系数与反应物的关系。
[关键词]反应热及热化学方程式的书写
[例2]在同温同压下,下列各组热化学方程式中Q2>Q1的是 ( )
A.2H2(g)+O2(g)=2H2O(g);△H=-Q1; 2H2(g)+O2(g)=2H2O(l);△H=-Q2
B.S(g)+O2(g)=SO2(g);△H=-Q1; S(s)+O2(g)=SO2(g);△H=-Q2
C.C(s)+1/2O2(g)=CO(g);△H=-Q1; C(s)+O2(g)=CO2(g);△H=-Q2
D.H2(g)+Cl2(g)=2HCl(g);△H=-Q1; 1/2H2(g)+1/2Cl2(g)=HCl(g);△H=-Q2。
[解析]A中,由于气态水转变为液态水要放出热量,所以生成液态水比生成气态水放出的热量要多,即Q2>Q1;B中,由于固态硫转变为气态硫要吸收热量,所以气态硫燃烧放出的热量比固态硫燃烧放出的热量多,即Q1>Q2;C中,生成CO放热,因氧气过量会与CO反应也放出热量,所以Q2>Q1,D中Q1=2Q2。
[答案]AC
[评析]反应放出或吸收热量的多少,跟反应物和生成物的聚集状态有密切关系。
[关键词]反应热及热化学方程式的书写
[例3]炽热的炉膛内有反应:C(s)+O2(g)=CO2(g);△H=-392kJ/mol,往炉膛内通入水蒸气时,有如下反应:C(s)+H2O(g)=CO(g)+H2(g);△H=+131kJ/mol,CO(g)+1/2O2(g)=CO2(g);△H=-282kJ/mol,H2(g)+1/2O2(g)=H2O(g);△H=-241kJ/mol,由以上反应推断往炽热的炉膛内通入水蒸气时 ( )
A.不能节省燃料,但能使炉火瞬间更旺 B.虽不能使炉火瞬间更旺,但可以节省燃料
C.既能使炉火瞬间更旺,又能节省燃料 D.既不能使炉火瞬间更旺,又不能节省燃料
[解析]本题应从两个方面考虑,一是能否使炉火瞬间更旺,由于往炉膛内通入水蒸气时,有如下反应发生:C(s)+H2O(g)=CO(g)+H2(g),生成的CO和H2都是可燃性气体,故能使炉火瞬间更旺。二是能否节省燃料,根据盖斯定律,C(s)+H2O(g)=CO(g)+H2(g);△H=+131kJ/mol,CO(g)+1/2O2(g)=CO2(g);△H=-282kJ/mol,H2(g)+1/2O2(g)=H2O(g);△H=-241kJ/mol,三个方程加合在一起即得总反应式C(s)+O2(g)=CO2(g);△H=-392kJ/mol,故与相同量的炭燃烧放出的热量相同,因此不能节省原料。
[答案]A
[评析]要熟练掌握运用盖斯定律进行热量的计算。
[关键词]反应热及热化学方程式的书写/碳族元素
[例4]已知胆矾溶于水时,溶液温度降低。在室温下将1mol无水硫酸铜制成溶液时,放出热量为Q1kJ,而胆矾分解的热化学方程式是CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q2kJ/mol,则Q1与Q2的关系是 ( )
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2 D.无法确定
[解析]由已知得CuSO4·5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l);△H=+Q(Q>0)……①,
CuSO4(s)=Cu2+(aq)+SO42-(aq);△H=-Q1……②,
①-②得CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H=Q1+Q,根据盖斯定律:Q1+Q=Q2,故D正确。
[答案]D
[评析]解此类题目常把题给信息转化为热化学方程,然后根据盖斯定律可得出正确的结论。
[关键词]反应热及热化学方程式的书写/氧族元素
[例5]已知有amolC和bmolO2(a>2b),充分反应后,将得到的可燃性物质提取后再次燃烧,充分反应。可燃性物质燃烧放出的热量有p%被mg、0℃的水吸收,使之沸腾。若已知1molC燃烧成CO2放出的热量为qJ,试求1molC燃烧成CO所放出的热量约为多少?(c=4.2×103J/kg·℃)
[解析]根据题意可知,可燃性物质燃烧后放出热量为:
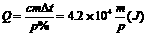 。又知:
。又知:
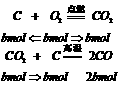
所以amolC和bmolO2(a>2b)反应后,其可燃性物质的量为(a-2b)molC和2bmolCO。若设1molCO燃烧成CO2放出的热量为xJ,则可得出关系式:
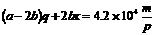
解得: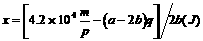
若设所求1molC燃烧成CO放出的热量为yJ,则由下列热化学方程式:
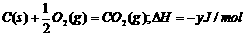 ①
①
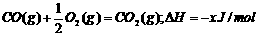 ②
②
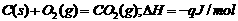 ③
③
就不难发现:①式=③式-②式,即为题目所求。故可推知:
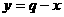
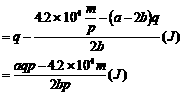
[答案](aqp-4.2×104m)/2bpJ
[评析]本题是一道物理、化学相互交叉渗透的综合计算题,难度大。因此,解决这类问题的关键在于分析题意,挖掘题中隐含着的重要信息(即热化学方程式有加合性),弄清该题中所涉及的两个过程,即物理过程与化学过程,并求出联系这两个过程的纽带--热量(Q)。然后正确运用所学物理、化学的有关基础知识,则题中的问题便可迎刃而解。
[关键词]反应热及热化学方程式的书写/碳族元素
[例6]接触法制硫酸的流程可表示如下:
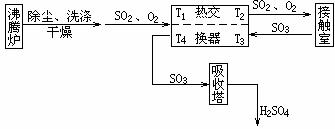
问:(1)热交换器在制硫酸的过程中有何重要作用?
(2)若以T1、T2、T3、T4分别表示进出热交换器的气体温度,且T1=80℃,T3=600℃、T4=250℃,求进入接触室后的SO2、O2混合气体的温度T2(设进、出热交换器的气体的平均比热均为0.8kJ/(kg•℃))。
(3)假定每天进入接触室的混合气体为20t,问与不用热交换器相比较每年至少可节省多少吨含碳80%的优质煤?(已知煤的供热效率为20%,C(s)+O2(g)=CO2(g);ΔH=-393kJ/mol)
[解析](1)由沸腾炉导出的SO2、O2等气体的温度经除尘、去杂、洗涤等工艺处理后已大幅度下降,通过热交换器后气体的温度又得以提高,这有利于后续反应(即由SO2合成SO3)的进行。SO2的氧化反应是放热反应,从接触室导出的SO3等气体的温度已高达600℃以上,难以被浓硫酸吸收。通过热交换器后SO3的温度下降了,这有利于提高浓硫酸对它的吸收效率。总而言之,热交换器在制H2SO4的过程中具有增效节能的作用。
(2)经过热交换器后,SO2、O2吸收的热量=cm1(T2-80℃),SO3放出的热量=cm2(600℃-250℃)。根据物理学原理及质量守恒定律可知,Q(吸)=Q(放),m1=m2,故cm1(T2-80℃)=cm2(600℃-250℃),即T2=430℃。
(3)若不使用热交换器,欲使80℃的SO2、O2预热到430℃,每年需提供的热量为20×103kg×365×0.8kJ/(kg•℃)×(430℃-80℃)=2.04×109kJ,每千克优质煤供给的有效热量为5240kJ/kg,使用热交换器后每年可节约优质煤的质量为:2.04×109kJ/(5240kJ/kg)=389.3t。
[答案](1)增效节能 (2)T2=430℃ (3)389.3t
[评析]本题主要运用公式Q=cmΔt考查化学反应中热效应的计算。
[关键词]反应热及热化学方程式的书写/氧族元素
2、要想提高中和热测定的准确性,实验时应注意的问题
(1)作为量热器的仪器装置,其保温隔热的效果一定要好。因此可用保温杯来做。如果按教材中的方法做,一定要使小烧杯杯口与大烧杯杯口相平,这样可以减少热量损失。
(2)盐酸和氢氧化钠溶液的浓度的配制须准确,且氢氧化钠溶液的浓度须稍大于盐酸的浓度。为使测得的中和热更准确,所用盐酸和氢氧化钠溶液的浓度宜小不宜大。
(3)温度计的水银球部分要完全浸没在溶液中,而且要稳定一段时间后再读数,以提高所测温度的精度。
(4)实验操作时动作要快,以尽量减少热量的散失。
(5)为了减少实验误差,重复实验2~3次,数据取平均值。
1、测定前的准备工作
(1)选择精密温度计(精确到0.10C),并进行校对(本实验温度要求精确到0.10C)。
(2)使用温度计要轻拿轻声放。刚刚测量高温的温度计不可立即用水冲洗,以免破裂。
(3)测量溶液的温度应将温度计悬挂起来,使水银球处于溶液中间,不要靠在烧杯壁上或插到烧杯底部。不可将温度计当搅拌棒使用。
2、书写热化学方程式的一般步骤
(1)依据有关信息写出注明聚集状态的化学方程式,并配平。
(2)根据化学方程式中各物质的化学计量数计算相应的反应热的数值。
(3)如果为放热反应ΔH为负值,如果为吸热反应则ΔH为正值。并写在第一步所得方程式的后面,中间用“;”隔开。
(4)如果题目另有要求,如反应燃料燃烧热的热化学方程式和有关中和热的热化学方程式,可将热化学方程式的化学计量数变换成分数。
1、书写热反应方程式应注意的问题:
(1)由于反应热的数值与反应的温度和压强有关,因此必须注明,不注明的是指101kPa和25℃时的数据。
(2)物质的聚集状态不同,反应热的数值不同,因此要注明物质的聚集状态。
(3)热化学方程式中的化学计量数为相应物质的物质的量,它可以是整数,也可以是分数。
3、中和热:在稀溶液中,酸跟碱发生中和反应生成1molH2O,这时的反应热叫做中和热。中学阶段主要讨论强酸和强碱的反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com