
题目列表(包括答案和解析)
7、下列反应中,既能表现出硝酸的酸性,又能表现出其氧化性的是( )
A、Fe2O3+HNO3 B、Al (OH)3+HNO3
C、C+HNO3(浓) D、Cu+HNO3
6、下列酸的酸酐难以由单质间直接化合生成的有( )
A、H2CO3 B、HNO3 C、H2SO3 D、H2SO4
5、Cu粉放A稀H2SO4中,加热后也无现象,当加入一种盐后,Cu粉质量减少,而
溶液变蓝,同时有气体生成,此盐是( )
A、氯化物 B、硫酸盐
C、硝酸盐 D、磷酸盐
4、可不用棕色瓶存放,但必须用玻璃塞试剂瓶存放的药品是( )
A、氯水 B、硝酸银溶液 C、液溴 D、烧碱
3、某二价金属跟硝酸反应时,金属与硝酸所消耗的物质的量之比为2:5,则反应中唯
一的还原产物可能是( )
A、NH3 B、N2O C、NO D、NO2
2、污染环境的有害气体中,主要由于跟血红蛋白作用而引起中毒的有毒气体是( )
A、SO2 B、CO2 C、NO D、CO
1、下列有关硝酸化学性质的叙述中正确的是( )
A、浓、稀硝酸都能使蓝色石蕊试剂变红
B、硝酸(过量)能与Na2SO3反应,但不生成SO2
C、稀硝酸可与Na2S反应制得H2S
D、在碘化钾淀粉溶液中滴加稀硝酸溶液呈蓝色
4.实战演练
3.例题精讲
例1、1.92gCu片与定量的浓HNO3作用,当收集到NO2和NO气体共1.12L时(标准状况),金属铜恰好全部作用。则反应中消耗HNO3_______mol被还原的HNO3________mol,转移电子________mol。
解析:ne=nCu×2=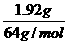 ×2=0.06mol
×2=0.06mol
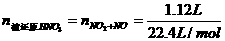 =0.05mol
=0.05mol
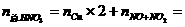
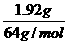 ×2+0.05mol=0.11mol
×2+0.05mol=0.11mol
答案:0.11、0.05、0.06。
例2、现有下列三个方案用于制取硝酸铜,要求:①不污染环境 ②原料利用率高。请对下列三个方案加以评价。
方案一:用铜屑与浓硝酸作用。
方案二:用铜屑与中等浓度的硝酸作用,生成的NO和NO2气体用NaOH吸收。
方案三:先将铜屑在空气中灼热,使其完全氧化,再用硝酸溶解上述产物。


 解析:方案一的制备反应为:Cu+4HNO3(浓) △ Cu (NO3)2+2NO2↑+2H2O。制备1mol Cu (NO3)2需4mol HNO3,反应放出的NO2未处理,对环境有污染。方案二的制备除含方案一反应外还有反应:3Cu+8HNO3=3Cu (NO3)2+2NO↑+4H2O,制备1mol Cu (NO3)2需
解析:方案一的制备反应为:Cu+4HNO3(浓) △ Cu (NO3)2+2NO2↑+2H2O。制备1mol Cu (NO3)2需4mol HNO3,反应放出的NO2未处理,对环境有污染。方案二的制备除含方案一反应外还有反应:3Cu+8HNO3=3Cu (NO3)2+2NO↑+4H2O,制备1mol Cu (NO3)2需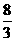 -4mol
HNO3。反应放出的NO2和NO可基本被吸收,对环境污染较小。方案三的制备反应也有两个:2Cu+O2 △
2CuO,
CuO+2HNO3=Cu (NO3)2+H2O,制备1mol Cu (NO3)2需2molHNO3,对环境的污染也较小。
-4mol
HNO3。反应放出的NO2和NO可基本被吸收,对环境污染较小。方案三的制备反应也有两个:2Cu+O2 △
2CuO,
CuO+2HNO3=Cu (NO3)2+H2O,制备1mol Cu (NO3)2需2molHNO3,对环境的污染也较小。
答案:由上综合分析可知,方案三最合理。
例3、在锌跟稀硝酸反应时,若参加反应的锌与消耗的硝酸的物质的量之比为1:2.5时,则被还原的HNO3和未被还原的HNO3的物质的量之比为
A、2:5 B、1:4 C、1:5 D、1:9
解析:Zn与HNO3的物质的量比为1:2.5即4:10。
则:4Zn+10HNO3=4Zn (NO3)2+N2O↑+5H2O ……………………①
4Zn+10HNO3=4Zn (NO3)2+NH4NO3↑+3H2O ……………………②
按反应①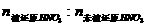 =1:4,按反应②
=1:4,按反应②
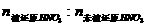 =1:9
=1:9
答案:BD。
例4、工业上由氮气制得氨气,氨再经催化氧化最终制得硝酸,如用去标准状况下560m3空气中的氮气(按N2占空气体积的4/5计算),则理论上可制得12mol/ L的硝酸多少立方米(设反应过程中氮损失16%)?
解析:生成硝酸的体积为V

 N2
2NH3
2HNO3
N2
2NH3
2HNO3
1 2
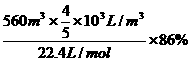 V×103L/m3×12mol/L
V×103L/m3×12mol/L
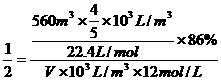
V=2.8m3
答:理论上可制得2.8m312mol/L的硝酸。
例5.同温同压下,两个等体积的干燥圆底烧瓶中分别充满:①NH3,②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为 ( )
A.①>② B.①<② C.①=② D.不能确定
解析:可先设烧瓶容积为1L,则NH3瓶中水充满整个烧瓶,NO2瓶中水充满烧瓶的2/3,如在标准状况下测定,则氨水的物质的量浓度为c=
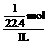 ,HNO3溶液物质的量浓度为c=
,HNO3溶液物质的量浓度为c=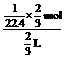 。参考答案:C
。参考答案:C
例6.从某些性质看,NH3与H2O相当,NH4+与H3O+,NH2-与O2-都有相当关系,下列有关方程式不正确的是 ( )
A. NH4Cl+KNH2=KCl+2NH3↑
B. M+2NH3=M(NH2)2+H2↑(M为二价活泼金属)
C. 2NH4Cl+MNH=MCl2+NH3
D. 2NH4Cl+MO=M(NH2)2+2HCl+H2O
解析:A中KNH2可看成KOH,反应正确,B中NH3可看成H2O,反应正确,C中MNH可看成MO,反应同样也正确,而D中若将NH4Cl看成H3OCl即HCl,则有反应2NH4Cl+MO=MCl2+NH3↑+H2O
2、硝酸的工业制法(氨的催化氧化法)
 氨氧化生成一氧化氮
氨氧化生成一氧化氮
两个阶段
一氧化氮氧化生成二氧化氮,二氮化氮被水吸收而生成硝酸
反应方程式:
 4NH3(气)+5O2(气) 催化剂
4NO(气)+6H2O(气)+907KJ
4NH3(气)+5O2(气) 催化剂
4NO(气)+6H2O(气)+907KJ
2NO(气)+O2(气)= 2NO2(气)+113kJ
3NO2(气)+ H2O(液)= 2HNO3(液)+NO(气)+136KJ
设备:氧化炉、吸收塔
吸收剂:水或稀硝酸
浓缩剂:硝酸镁或浓硫酸
尾气吸收剂:氢氧化钠溶液。(NO+NO2+NaOH=2NaNO2+H2O)
注意点:在吸收反应进行过程中补充一些空气,使吸收生成的NO再氧化为NO2,NO2
 溶于水又生成HNO3和NO,经过多次的氧化和吸收,二氧化氮可以完全地被水吸收,能够尽可能多地转化为硝酸。因此起始物和反应终产物物质的量间关系为:1molNH3 转化 1molHNO3。
溶于水又生成HNO3和NO,经过多次的氧化和吸收,二氧化氮可以完全地被水吸收,能够尽可能多地转化为硝酸。因此起始物和反应终产物物质的量间关系为:1molNH3 转化 1molHNO3。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com