
题目列表(包括答案和解析)
3.例题精讲
例1.同温同压下,两个等体积的干燥圆底烧瓶中分别充满:①NH3,②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为 ( )
A.①>② B.①<② C.①=② D.不能确定
解析:可先设烧瓶容积为1L,则NH3瓶中水充满整个烧瓶,NO2瓶中水充满烧瓶的2/3,如在标准状况下测定,则氨水的物质的量浓度为c=
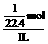 ,HNO3溶液物质的量浓度为c=
,HNO3溶液物质的量浓度为c=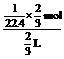 。参考答案:C
。参考答案:C
例2.从某些性质看,NH3与H2O相当,NH4+与H3O+,NH2-与O2-都有相当关系,下列有关方程式不正确的是 ( )
A. NH4Cl+KNH2=KCl+2NH3↑
B. M+2NH3=M(NH2)2+H2↑(M为二价活泼金属)
C. 2NH4Cl+MNH=MCl2+NH3
D. 2NH4Cl+MO=M(NH2)2+2HCl+H2O
解析:A中KNH2可看成KOH,反应正确,B中NH3可看成H2O,反应正确,C中MNH可看成MO,反应同样也正确,而D中若将NH4Cl看成H3OCl即HCl,则有反应2NH4Cl+MO=MCl2+NH3↑+H2O
例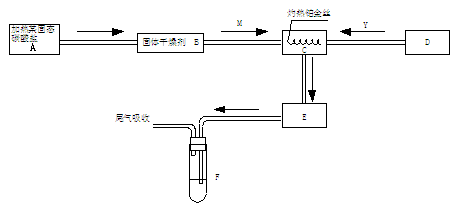 3.某化学课外小组所做实验的示意图如下图
3.某化学课外小组所做实验的示意图如下图
 图中“ ”表示气体流向,M是一种子纯净而干燥的气体,Y为另一种气体。当与M气体反应时y气体过量,E内有棕色气体产生。实验所用到的物质只能由下列物质中选取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3碱石灰等固体及蒸镏水。据此实验,完成下列填空:
图中“ ”表示气体流向,M是一种子纯净而干燥的气体,Y为另一种气体。当与M气体反应时y气体过量,E内有棕色气体产生。实验所用到的物质只能由下列物质中选取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3碱石灰等固体及蒸镏水。据此实验,完成下列填空:
(1) A中所用装置的主要仪器有
(2)B中所选的干燥剂是 ,作用是 。
(3)C中发生的主要反应的化学方程式是
(4)制取y气体的D装置所用的主要仪器是
制取y的化学方程式是 。
(1)当F中为紫色石蕊试液时,见到的现象是 主要反应方程式为 、 。
解析:解此题抓住两点:①产生C(或E)气体的条件为Pt丝红热②E内有红棕色即为NO2,得知M为NH3,y为O2,C中有NO、NO2、H2O(g)等。
答案:(1)大试管,铁架台(附铁夹),酒精灯,单孔塞和玻璃管。
(2) 碱石灰,既除去水蒸气又除去CO2.
 (3)4NH3+5O2 Pt 4NO+6H2O (气)
(3)4NH3+5O2 Pt 4NO+6H2O (气)
(4)平底烧瓶,分液漏斗,胶塞 ,导管(用锥形瓶代替平底烧瓶也可)
 2Na2O2 +2H2O
= 4NaOH + O2
2Na2O2 +2H2O
= 4NaOH + O2
(5)紫色石蕊试液变红,3NO2+H2O=2HNO3+NO,HNO3=H++NO –3。
例4在室温时有50ml的混合气体,它们可能由HCl、NH3、CO2、NO组成。将这些混合气体通过浓H2SO4后体积减少为35ml ,再通过过量的过氧化钠气体体积又减少为20ml,最后将气体通过水,充分反应后只剩下10ml 气体。(所有气体体积在同温同压下测定)求:
① 混合气体由哪些气体组成?它们的各占多少毫升?
② 最后剩余气体是什么气体?
解析:50ml混合气体通过浓H2SO4体积减少为35ml,则NH3体积为50ml-35ml=15ml。由此确定无HCl。由题意可知还有CO2和NO。设含CO2为xml,NO为yml,若最后10ml为NO,则由:3NO2+H2O=2HNO3+NO可知需NO2为30ml>20ml,不合题意,若最后10ml为O2,则由4NO+3O2+2H2O=4HNO3可知ymlNO需消耗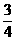 ymlO2,再由2CO2+2Na2O2=2NaCO3+O2得生成O2为
ymlO2,再由2CO2+2Na2O2=2NaCO3+O2得生成O2为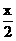 ml,
ml,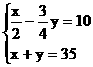 解得
解得 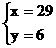
则NH3为15ml,CO2为29ml,NO为6ml
答案:①混合气体由29mlCO2,15mlNH3,6mlNO组成。②剩余气体为O2,其体积为10ml.
例5 在密闭容器中,放入碳酸铵和氢氧化钠固体共Ag,将容器加热至200℃,经充分反应后,排出其中气体,冷却后称得剩余固体的质量为Bg,问容器内碳酸铵和氢氧化钠各多少克?
 解析:可能发生如下反应:
解析:可能发生如下反应:
(NH4)2CO2 + 2NaOH === 2NH3↑+ 2H2O + Na2CO3 ………①
(NH4)2CO3 === 2NH3↑+ CO2↑+ H2O↑……………………②
在加热过程中应首先发生反应①,只有当(NH4)2CO3过量时才能继续发生反应②。并由以上反应可以看出,NaOH过量时减重少,残留固体只有两种情况。一当(NH4)2CO3正好作用或过量时残留物为Na2CO3,二当NaOH过量时残留物为Na2CO3和NaOH的混合物,下面分别讨论。
10据反应(NH4)2CO3 + 2NaOH === Na2CO3 + 2NH3↑+ 2H2O↑
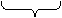 96 80
96 80
176 106 34 36
A B
当A/B=176/106即A= B时,两者恰好反应
B时,两者恰好反应
20当NaOH过量时,即A> B时,根据减少质量确定(NH4)2CO3质量
B时,根据减少质量确定(NH4)2CO3质量

30当(NH4)2CO3过量,即A<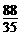 B时,残留固体为Na2CO3,可确定参加反应的NaOH的质量。
B时,残留固体为Na2CO3,可确定参加反应的NaOH的质量。
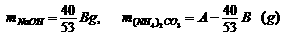
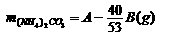
答案:(1)当(NH4)2CO3过量或正好作用时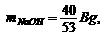
(2)当NaOH过量时,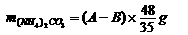
2. 实验室制法
①
 药品:铵盐(氯化铵)与消石灰固体混合加热
药品:铵盐(氯化铵)与消石灰固体混合加热
②反应方程式:2NH4Cl +Ca(OH)2 CaCL2+2NH3 +2H2O
 ③装置:固体
加热 气体,同于实验室用KClO3和MnO2固体混合加热制O2装置
③装置:固体
加热 气体,同于实验室用KClO3和MnO2固体混合加热制O2装置
④干燥:常用碱石灰作干燥剂,不能用酸性干燥剂如浓H2SO4、P2O5等。
⑤收集:只能用向下排空气法。
⑥验满:用湿润的红色石蕊试纸放在试管口,也可用玻璃棒蘸有浓氨水,靠近试管口。
⑦注意:a.棉花的作用为防止气体对流,提高收集氨气的速率和纯度。b.不使用NaOH的原因是加热时NaOH碱性强,容易腐蚀试管。消石灰碱性相对弱,且比较疏松,氨气容易逸出。c.制取干燥氨气也不能用CaCl2作干燥剂,原因是CaCl2和NH3加合生成CaCl2·8NH3。
1. 工业制法其反应方程式:
 N2+3H2 高温、高压
N2+3H2 高温、高压 2NH3
2NH3
2、 铵盐的分解规律
 (1)不稳定性酸的铵盐分解产物为NH3和酸酐及水。如NH4HCO3 NH3+CO2+H2O
(1)不稳定性酸的铵盐分解产物为NH3和酸酐及水。如NH4HCO3 NH3+CO2+H2O
 (2)挥发性酸对应的铵盐产物为NH3和相应酸。如 NH4Cl
NH3+HCl
(2)挥发性酸对应的铵盐产物为NH3和相应酸。如 NH4Cl
NH3+HCl
(3)氧化性酸的铵盐分解产物不附合上述规律。如NH4NO3和(NH4)2SO4(因HNO3和H2SO4有强氧化性,NH3在加热时有还原性)
(1)结构:离子晶体,具有离子键、共价键和配位键,是由非金属元素组成的离子化合物。
(2)物理性质:都是晶体,都易溶于水。
(3)化学性质
 ①不稳定性:铵盐受热易分解
①不稳定性:铵盐受热易分解
 NH4Cl NH3+HCl
NH4Cl NH3+HCl
NH4HCO3 NH3↑+CO2↑+H2O
 NH4NO3受热分解较复杂:
NH4NO3受热分解较复杂:
NH4NO3 N2O+2H2O
 2NH4NO3 2N2↑ +O2↑+4H2O
2NH4NO3 2N2↑ +O2↑+4H2O
②与碱反应
 NH4++OH―
NH3·H2O
NH4++OH―
NH3·H2O
或NH4++OH― NH3↑+H2O
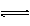 ③水解反应:
③水解反应:
NH4++H2O NH3·H2O+H+
(4)用途:可用作氮肥,炸药,焊药。
(5)NH4+的检验:
往待测液中加入NaOH溶液加热,放出能使湿润红色石蕊试纸变蓝的气体,则证明含NH4+。
原理、规律、疑难剖析:
1、 关于氨水的几个问题
(1)氨气或液氨溶于水得氨水,氨水的密度比水小,并且氨水浓度越大密度越小,计算氨水浓度时,溶质是NH3,而不是NH3•H2O。
(2)在氨水溶液中存在如下平衡:NH3+H2O
 NH3•H2O
NH3•H2O
 NH4++OH-,氨水显弱碱性,具有碱的通性。氨水可使红色石蕊试纸变蓝,故常用湿润的红色石蕊试纸检验NH3的存在。
NH4++OH-,氨水显弱碱性,具有碱的通性。氨水可使红色石蕊试纸变蓝,故常用湿润的红色石蕊试纸检验NH3的存在。
(3)氨水是混合物,溶液中存在微粒有:
 三种分子:NH3•H2O、NH3、H2O
三种分子:NH3•H2O、NH3、H2O
三种离子:NH4+、OH-、及少量H+
(4)氨水是弱电解质溶液,但电解质是NH3•H2O而不是NH3。
(5)氨水是很好的沉淀剂,可使多种阳离子:Mg2+、Fe3+、Al3+、Ag+、Cu2+等生成沉淀。其中AgOH、(或Ag2O)、Cu(OH)2 等沉淀遇过量的氨水会生成络离子而溶解。如:
Al3++3 NH3•H2O=Al(OH)3↓ +3NH4+
Ag++ NH3•H2O=AgOH+NH4+
2AgOH=Ag2O+H2O
Ag2O +4 NH3•H2O=2[Ag(NH3)2]+ +2OH―+3H2O
利用此性质在实验室中用氨水制取Al(OH)3 和银氨溶液。
(6)涉及氨水的离子方程式的书写
①氨水作反应物,用分子式NH3•H2O表示。
 ②生成氨水时,如使用的反应物为浓溶液或在加热条件下,用下式表示:
②生成氨水时,如使用的反应物为浓溶液或在加热条件下,用下式表示:
NH4++OH― NH3↑+H2O
③生成氨水时,如使用的反应物为稀溶液,用下式表示:NH4++OH― = NH3·H2O
3.氨的工业制法

N2+3H2 2NH3
1.氨的结构、性质和用途
(1)氨的结构:
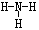
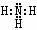
电子式: 结构式:
空间构型:三角锥形;NH3是极性分子。
(2)物理性质:无色有特殊剌激性气味的气体,极易溶于水,常温常压下1体积水能溶解700体积的NH3 。
(3)化学性质:
①与水反应:

 NH3+H2O NH3·H2O NH4++OH―
NH3+H2O NH3·H2O NH4++OH―
NH3是唯一能使湿润的红色石蕊试纸变蓝的气体,常用此性质检验NH3。
②与酸的反应:
NH3+HCl=NH4Cl(生成白烟)
NH3+CO2+H2O=NH4HCO3
③与氧化剂反应:
4NH3+3O2 4NO+6H2O

2NH3+3CuO N2+3Cu+3H2O
8NH3+3Cl2 = N2 + 6NH4Cl
 2.氨的实验室法:用铵盐与碱共热
2.氨的实验室法:用铵盐与碱共热
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
①发生装置:固+固+加热型。与制备O2 和CH4 气体相似;收集NH3 用向下排空气法收集。
②检验:a.用润湿的红色石蕊试纸检验;
b.用沾有浓盐酸的玻璃棒检验,产生白烟。
③干燥:不能用CaCl2、P2O5、浓硫酸作干燥剂,因为NH3能与CaCl2反应生成CaCl2·8NH3。P2O5与浓硫酸均能与NH3反应,生成相应的盐。所以NH3通常用碱石灰干燥。
14、①NH4HCO3或(NH4)2CO3,NH3,NO2
②2CO2+2Na2O2=2Na2CO3+O2
③3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
13、①S,H2S,SO2,SO3,H2SO4
②N2,NH3,NO,NO2,HNO3
12、取少许晶体于洁净试管中加入适量浓硫酸后,插入一根螺旋状粗铜丝,如有红棕色
气体迅速产生,即证明晶体中有硝酸根离子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com