
题目列表(包括答案和解析)
1、 化学方法分离和提纯物质
对物质的分离可一般先用化学方法对物质进行处理,然后再根据混合物的特点用恰当的分离方法(见化学基本操作)进行分离。
用化学方法分离和提纯物质时要注意:
①最好不引入新的杂质;
②不能损耗或减少被提纯物质的质量
③实验操作要简便,不能繁杂。用化学方法除去溶液中的杂质时,要使被分离的物质或离子尽可能除净,需要加入过量的分离试剂,在多步分离过程中,后加的试剂应能够把前面所加入的无关物质或离子除去。
对于无机物溶液常用下列方法进行分离和提纯:
(1)生成沉淀法 例如NaCl溶液里混有少量的MgCl2杂质,可加入过量的NaOH溶液,使Mg2+离子转化为Mg(OH)2沉淀(但引入新的杂质OH-),过滤除去Mg(OH)2,然后加入适量盐酸,调节pH为中性。
(2)生成气体法 例如Na2SO4溶液中混有少量Na2CO3,为了不引入新的杂质并增加SO42-,可加入适量的稀H2SO4,将CO32-转化为CO2气体而除去。
(3)氧化还原法 例如在 FeCl3溶液里含有少量 FeCl2杂质,可通入适量的Cl2气将FeCl2氧化为FeCl3。若在 FeCl2溶液里含有少量 FeCl3,可加入适量的铁粉而将其除去。
(4)正盐和与酸式盐相互转化法 例如在Na2CO3固体中含有少量NaHCO3杂质,可将固体加热,使NaHCO3分解生成Na2CO3,而除去杂质。若在NaHCO3溶液中混有少量Na2CO3杂质,可向溶液里通入足量CO2,使Na2CO3转化为NaHCO3。
(5)利用物质的两性除去杂质 例如在Fe2O3里混有少量的Al2O3杂质,可利用Al2O3是两性氧化物,能与强碱溶液反应,往试样里加入足量的 NaOH溶液,使其中 Al2O3转化为可溶性 NaAlO2,然后过滤,洗涤难溶物,即为纯净的Fe2O3。
(6)离子交换法 例如用磺化煤(NaR)做阳离子交换剂,与硬水里的Ca2+、Mg2+进行交换,而使硬水软化。
4、气体实验装置的设计
(1)装置顺序:制气装置→净化装置→反应或收集装置→除尾气装置
(2)安装顺序:由下向上,由左向右
(3)操作顺序:装配仪器→检验气密性→加入药品
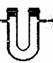
3、净化与干燥装置
(1)设计原则:根据净化药品的状态及条件
(2)装置基本类型:
|
装置类型 |
液体除杂剂(不加热) |
固体除杂剂(不加热) |
固体除杂剂(加热) |
|
适用范围 |
|
|
|
|
装 置 示意图 |
 |
 |
 |
(3)气体的净化剂的选择
选择气体吸收剂应根据气体的性质和杂质的性质而确定,所选用的吸收剂只能吸收气体中的杂质,而不能与被提纯的气体反应。一般情况下:①易溶于水的气体杂质可用水来吸收;②酸性杂质可用碱性物质吸收;③碱性杂质可用酸性物质吸收;④水分可用干燥剂来吸收;⑤能与杂质反应生成沉淀(或可溶物)的物质也可作为吸收剂。
(4)气体干燥剂的类型及选择
常用的气体干燥剂按酸碱性可分为三类:
①酸性干燥剂,如浓硫酸、五氧化二磷、硅胶。酸性干燥剂能够干燥显酸性或中性的气体,如CO2、SO2、NO2、HCI、H2、Cl2 、O2、CH4等气体。
②碱性干燥剂,如生石灰、碱石灰、固体NaOH。碱性干燥剂可以用来干燥显碱性或中性的气体,如NH3、H2、O2、CH4等气体。
③中性干燥剂,如无水氯化钙等,可以干燥中性、酸性、碱性气体,如O2、H2、CH4等。
在选用干燥剂时,显碱性的气体不能选用酸性干燥剂,显酸性的气体不能选用碱性干燥剂。有还原性的气体不能选用有氧化性的干燥剂。能与气体反应的物质不能选作干燥剂,如不能用CaCI2来干燥NH3(因生成 CaCl2·8NH3),不能用浓 H2SO4干燥 NH3、H2S、HBr、HI等。
气体净化与干燥注意事项
一般情况下,若采用溶液作除杂试剂,则是先除杂后干燥;若采用加热除去杂质,则是先干燥后加热。
对于有毒、有害的气体尾气必须用适当的溶液加以吸收(或点燃),使它们变为无毒、无害、无污染的物质。如尾气Cl2、SO2、Br2(蒸气)等可用NaOH溶液吸收;尾气H2S可用CuSO4或NaOH溶液吸收;尾气CO可用点燃法,将它转化为CO2气体。
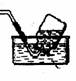
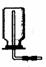
2、收集装置
(1)设计原则:根据氧化的溶解性或密度
(2)装置基本类型:
|
装置类型 |
排水(液)集气法 |
向上排空气集气法 |
向下排空气集气法 |
|
装 置 示意图 |
 |
 |
 |
|
适用范围 |
不溶于水(液)的气体 |
密度大于空气的气体 |
密度小于空气的气体 |
|
典型气体 |
H2、O2、NO、CO、CH4、 CH2=CH2、CH≡CH |
Cl2、HCl、CO2、SO2、H2S |
H2、NH3、CH4 |
14、N2
NaNO2+NH4Cl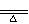 NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
13、C2H4 C2H5OH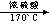 CH2=CH2↑+H2O
CH2=CH2↑+H2O
12、HCl
NaCl(固)+H2SO4(浓) NaHSO4+HCl↑
NaHSO4+HCl↑
NaCl(固)+NaHSO4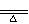 Na2SO4+HCl↑
Na2SO4+HCl↑
2NaCl(固)+H2SO4(浓)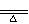 Na2SO4+2HCl↑
Na2SO4+2HCl↑
11、Cl2
MnO2+4HCl(浓)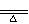 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
10、C2H2 CaC2+2H2O→Ca(OH)2+CH≡CH↑
9、NO 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com