
题目列表(包括答案和解析)
3.根据标准状况下,一定质量气体的体积计算相对分子质量.
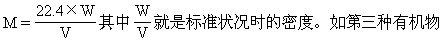
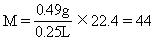
答案:58、54、 44
[例6] 某气态碳氢化合物中含碳75%,它的密度是同温同压下氢气密度的8倍,求有机物的分子式.
分析:计算推断分子式此题有三种方法
2.根据气体相对密度计算相对分子质量.M=DA×MA用相对密度乘相对气体的相对分子质量.如第二种有机物M=1.87×29=54
[例4] 某烃含碳氢两元素的质量比为3∶1,该烃对H2的相对密度为8,试确定该烃的分子式.
分析:解法一:Mr=2×8=16,M=16g·mol-1,1mol烃中含C、H的物质的量为:
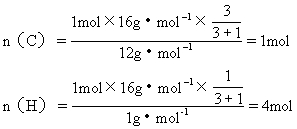
所以该烃的分子式为CH4.
解法二:烃分子中C、H原子个数比为:
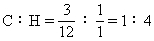
最简式为CH4,式量为16.
因为Mr=16,故该烃的分子式为CH4.
答案:CH4
[例5] 已知第一种气态有机物在标准状况下的密度为2.59g/L,第二种气态有机物对空气的相对密度为1.87,第三种气态有机物在标准状况下250mL质量为0.49g.求这三种有机物的相对分子质量.
分析:计算相对分子质量有三种不同方法
1.根据标准状况下气体的密度计算相对分子质量.根据标准状况的气体密度计算气体的摩尔质量,其数值即为相对分子质量.M=22.4×d 如第一种有机物 M=22.4×2.59=58
[例1]实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。又测得该化合物的相对分子质量是30,求该化合物的分子式。
[解]:(1)实验式是表示化合物分子所含各元素的原子数目最简单整数比的式子,求化合物的实验式即是求该化合物分子中各元素原子的数目(N)之比。
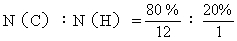
=1∶3
该化合物的实验式是CH3。
(2)设该化合物分子中含有n个CH3,则:
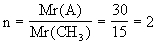
该化合物的分子式是C2H6。
答:该碳氢化合物的实验式是CH3,分子式是C2H6。
[例2]2.3g某有机物A完全燃烧后,生成0.1 mol CO2和 2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式。
[分析]根据实验,该有机物燃烧的产物只有CO2和H2O,因此,该有机物中一定含有C和H;至于O,由于其可能全部来自于燃烧时空气所提供的氧气,也可能来自于该有机物本身。因此,该有机物分子中是否含有O,还需要通过计算反应物中C、H质量之和并与该有机物质量进行比较后,才能作出判断。该有机物的相对分子质量,则可以利用实验测出的相对密度来求。
[解]:(1)求2.3g该有机物中组成元素的质量:
C: C → CO2
12 44
m(C) 44g/mol×0.1mol
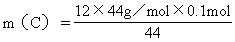
=1.2g
H: 2H → H2O
2 18
m(H) 2.7g
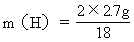
=0.3g
m(C)+m(H)=1.2g+0.3g=1.5g<2.3g
该有机物中C的质量与H的质量之和(1.5g)小于该有机物的质量
2.3g),因此该有机物A中还含有O,其质量为:
m(O)=m(A)-m(C)-m(H)
=2.3g-1.5g
=0.8g
(2)求该有机物的相对分子质量:
Mr(A)=d×Mr(空气)
=1.6×29
=46
(3)求该有机物分子中各元素原子的数目:
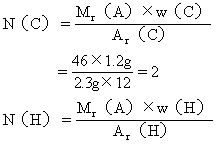
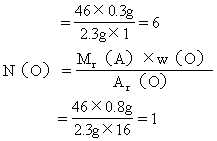
答:该有机物的分子式是C2H6O。
[例3]0.60g某饱和一元醇 A,与足量的金属钠反应,生成氢气112mL(标准状况)。求该一元醇的分子式。
[解]:饱和一元醇的通式为CnH2n+1OH,该一元醇的摩尔质量为
M(A)。
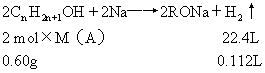
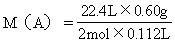
=60g/mol
该一元醇的相对分子质量是60。
根据该一元醇的通式,有下列等式:
12n+2n+1+16+1=60
n=3
答:该一元醇的分子式是C3H7OH。
3、
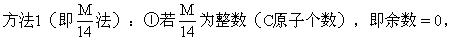
则为烯烃,环烷烃.
②若余数=2,则为烷烃.
③若余数=-2,则为炔烃.二烯烃
④若余数=-6,则为苯的同系物.

若分子式不合理,可减去一个C原子,加上12个H原子
有机物分子式的确定典型例题
例题精讲
2、 ①有机物各元素的质量分数(或质量比)
②标准状况下的有机物蒸气的密度(或相对密度)
1、最简式法;直接法;燃烧通式法;商余法(适用于烃的分子式的求法等
3.如何运用“商余法”确定烃的分子式?
问题与思考(提示)
2.运用“最简式法”确定有机物分子式,需哪些数据?
由于有机化合物中存在着同分异构现象,因此一个分子式可能代表两种或两种以上具有不同结构的物质。在这种情况下,知道了某一物质的分子 式,常常可利用该物质的特殊性质,通过定性或定量实验来确定其结构式。例如:
根据乙醇的分子式和各元素的化合价,乙醇分子可能有两种结构:

为了确定乙醇究竟是哪一种结构,我们可以利用乙醇跟钠的反应,做下面这样一个实验。实验装置如右下图所示。在烧瓶里放入几小块钠,从漏斗中缓缓滴入一定物质的量的无水乙醇。乙醇跟适量钠完全反应放出的H2把中间瓶子里的水压入量筒。通过测量量筒中水的体积(应包括由广口瓶到量筒的导管内的水柱的体积),就可知反应生成的H2的体积。
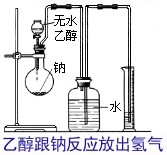
讨论2 下面是上述实验的一组数据:

根据上述实验所得数据,怎样推断乙醇的结构式是(1),还是(2)呢?
由于0.100 mol C2H6O与适量Na完全反应可以生成1.12 L H2,则1.00 mol C2H6O与Na反应能生成11.2 L H2,即0.5 mol H2,也就是1 mol H。这就是说在1个C2H6O分子中;只有1个H可以被Na所置换,这说明C2H6O分子里的6个H
中,有1个与其他5个是不同的。这一事实与(1)式不符,而与(2)式相符合。因此,可以推断乙醇的结构式应为(2)式。
问题与思考
1.确定有机物分子式一般有哪几种方法?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com