
题目列表(包括答案和解析)
6.同系物概念
分子结构相似,在分子组成上相差一个或若干个CH2原子团的物质,互称为同系物。
[练习]下列各组内的物质不属于同系物的是( C )
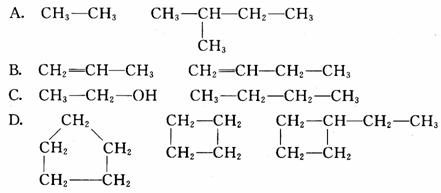
(强调):在判断同系物的时候要严格把握同系物概念涵义的两个方面:一是分子结构相似,二是分子组成上相差一个或若干个CH2原子团,二者要联系在一起应用,缺一不可。当然,还应注意,同系物的关系不光是只有烷烃分子之间存在,在其他的有机物内也存在着同系物关系。
小结:本节课我们学习和讨论了几个重要的概念:烷烃、结构简式以及同系物,通过研究分析,讨论比较从而得出了烷烃分子的结构特点,以及烷烃的物理和化学性质的变化规律,当然在学习时应重点掌握烷烃性质的变化规律。
5.烷烃的通式:CnH2n+2
CH4 C2H6 C3H8 C4H10 C5H12……
若烷烃分子的碳原子数为n,那么氢原子的数目就可表示为2n+2,这样烷烃的分子式就可以表示为CnH2n+2。
大家再比较一下相邻碳原子数的烷烃在分子组成上有何特点,当然也可以用通式来推算。(可以通过观察表5-1中的结构简式,也可以用通式推算,用CnH2n+2减去Cn-1H2(n-1)+2,都可以得到相同的结论):在分子组成上相差一个或若干个CH2原子团。
4.烷烃的化学性质
(1)通常状况下,它们很稳定,跟酸、碱及氧化物都不发生反应,也难与其他物质化合;
(2)在空气中都能点燃;
(3)它们都能与氯气发生取代反应。(评价并补充说明)
(1)烷烃与氯气也可以是溴在光照条件下发生的取代反应,由于碳原子数的增多而使生成的取代产物的种类将更多;例如:甲烷的氯代物有:一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷共四种氯代物。同学们算乙烷的氯代物有几种?
答案:9种。(实验班可以讲规律)
(2)在空气或氧气中点燃烷烃,完全燃烧的产物为CO2和H2O,相同状况下随着烷烃分子里碳原子数的增加往往会燃烧越来越不充分,使燃烧火焰明亮,甚至伴有黑烟;
(3)烷烃分子也可以分解,但产物不一定为炭黑和氢气,这在以后的石油裂化-裂解的学习中就将学到。
3.烷烃的物理性质
学生自学P116思考、分析表中数据,讨论,并得出一些规律。
(a)随着分子里含碳原子数的增加,熔点、沸点逐渐升高,相对密度逐渐增大;
(b)分子里碳原子数等于或小于4的烷烃。在常温常压下都是气体,其他烷烃在常温常压下都是液体或固体;
(c)烷烃的相对密度小于水的密度。(评价学生的回答,然后补充说明)
(1)表中所列烷烃均为无支链的烷烃,常温常压下是气体的烷烃除了上述碳原子数小于或等于4的几种分子之外,还有一种碳原子数为5的分子,但分子中含有支链的戊烷,
(2)烷烃分子均为非极性分子,故一般不溶于水,而易溶于有机溶剂,液态烷烃本身就是良好的有机溶剂。
[设疑]烷烃分子的熔沸点为什么会随着碳原子数的增大即相对分子质量的提高而升高呢?
由于随着相对分子质量的增大,分子之间的范德华力逐渐增大,从而导致烷烃分子的熔沸点逐渐升高。
甲烷与其他烷烃结构的相似不仅表现在物理性质上的规律性变化,而且化学性质上也具有极大的相似性。
2. 烷烃的结构式和结构简式
甲烷 乙烷 丙烷 丁烷
结 构 式:
结构简式:CH4 CH3CH3 CH3CH2CH3 CH3CH2CH2CH3 /CH3(CH2)2CH3
这种式子,书写起来是比较方便的,我们称之为有机物的结构简式。当然,在书写有机物分子的结构简式时,若遇到像丁烷分子中有两个(或多个)相同的成分时,还可以写成CH3(CH2)2CH3。
由于结构简式书写方便,且仍能表示出分子结构的简况,所以更多情况下常使用结构简式。
既然甲烷的结构和其他的烷烃分子很相似,那么它们在性质上是否也很相似呢?
1.烷烃的概念
a.分子里碳原子都以单键结合成链状;
b.碳原子剩余的价键全部跟氢原子结合.
3.甲烷的受热分解
CH4 C+2H2
C+2H2
这么高的温度才分解,说明甲烷的热稳定性很强。
小结:本节课我们开始了对有机物的系统学习,介绍了有机物、烃的概念,解释了有机物种类繁多的主要原因;认识到甲烷的正四面体立体结构和它的几个重要化学性质:氧化反应、取代反应、受热分解反应,学习中重点应对甲烷和Cl2的取代反应加以理解,当然也要树立结构和性质紧密相关的观点。
教学说明
本章是学习有机物的开始,俗话说:万事开头难。因此在教学中注重了以周围熟悉的有机物引入有机物的概念,从有机物的重要用途来激发学生学习有机物的兴趣。为了让学生对甲烷的分子结构有一个正确的认识,采用了模型展示的方法;通过实验演示甲烷的取代反应和不能被酸性高锰酸钾溶液氧化的事实以及投影分析取代反应的过程,不仅提高了广大学生的分析思考问题、动手的能力,同时还帮助学生树立科学的学习和分析方法。
2.甲烷的取代反应
[演示实验5-2]
现象:①量筒内Cl2的黄绿色逐渐变浅,最后消失。
②量筒内壁出现了油状液滴。
③量筒内水面上升。
④量筒内产生白雾
[投影显示]甲烷与氯气的反应过程
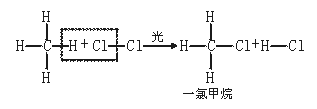
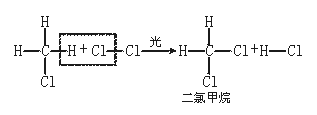
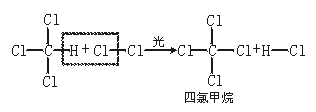
[说明]在反应中CH4分子里的1个H原子被Cl2分子里的1个Cl原子所代替,但是反应并没有停止,生成的一氯甲烷仍继续跟氯气作用,依次生成二氯甲烷、三氯甲烷和四氯甲烷,反应如下:

a.注意CH4和Cl2的反应不能用日光或其他强光直射,否则会因为发生如下剧烈的反应:CH4+2Cl2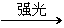 C+4HCl而爆炸。
C+4HCl而爆炸。
b.在常温下,一氯甲烷为气体,其他三种都是液体,三氯甲烷(氯仿)和四氯甲烷(四氯化碳)是工业重要的溶剂,四氯化碳还是实验室里常用的溶剂、灭火剂,氯仿与四氯化碳常温常压下的密度均大于1 g·cm-3,即比水重。
c.分析甲烷的四种氯代物的分子极性。但它们均不溶于水。(实验班)
取代反应 有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应
1.甲烷的氧化反应
CH4+2O2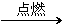 CO2+2H2O
CO2+2H2O
 a.方程式的中间用的是“ ”(箭头)而不是“====”(等号),
a.方程式的中间用的是“ ”(箭头)而不是“====”(等号),
主要是因为有机物参加的反应往往比较复杂,常有副反应发生。
b.火焰呈淡蓝色:CH4、H2、CO、H2S
我们知道酸性KMnO4具有很强的氧化性,若遇到一般的还原性物质时常常会发生氧化还原反应,且自身被还原而褪色 ,那么甲烷能否被酸性高锰酸钾溶液氧化呢?我们通过下面的实验来验证。
[演示实验5-1]观察、记录、思考实验现象:经过一段时间后,酸性KMnO4溶液的颜色无任何变化,即不褪色。
结论:甲烷气体不能被酸性KMnO4溶液氧化。
在通常条件下,甲烷不仅与高锰酸钾等强氧化剂不反应,而且与强酸、强碱也不反应,所以可以说甲烷的化学性质是比较稳定的。但稳定是相对的,在一定条件下也可以与一些物质如Cl2发生某些反应。(承上启下,并对学生进行辩证唯物主义的教育)
已知甲烷的气体密度在标准状况下为0.717 g/L,其中含碳的质量分数为75%,含氢质量分数为25%,求甲烷的分子式。(平行班提示:M=ρVm)
a.计算甲烷的摩尔质量
因为摩尔质量=气体摩尔体积×密度
=22.4L/mol×O.7179/L
=16 g/mol
所以甲烷的分子量为16。
b.按分子量和质量分数计算一个甲烷分子中C、H原子的个数
C原子数:16×75%÷12=1
H原子数:16×25%÷1=4
所以甲烷的分子式为CH4。
甲烷的分子式:CH4 电子式: 结构式:
用短线表示一对共用电子对的图式叫结构式。
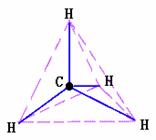
上述结构式都不能表明甲烷分子的真实构型
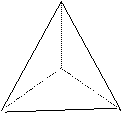
[模型展示]甲烷分子的球棍模型和比例模型。
得出结论:以碳原子为中心,四个氢原子为顶点的正四面体结构。
甲烷是非极性分子,所以甲烷极难溶于水,这体现了相似相溶原理。
CH4:正四面体 NH3:三角锥形
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com