
题目列表(包括答案和解析)
1、要判断电解产物是什么,必须理解溶液中离子放电顺序
阴极放电的总是溶液中的阳离子,与电极材料无关。放电顺序是
K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+(H+)、Cu2+、Hg2+、Ag+、Au3+
 放电由难到易
放电由难到易
阳极:若是惰性电极作阳极,溶液中的阴离子放电,放电顺序是
 S2-、I-、Br-、Cl-、OH-、含氧酸根离子(NO3-、SO42-、CO32-)、F-
S2-、I-、Br-、Cl-、OH-、含氧酸根离子(NO3-、SO42-、CO32-)、F-
失电子由易到难
若是非惰性电极作阳极,则是电极本身失电子。
要明确溶液中阴阳离子的放电顺序,有时还需兼顾到溶液的离子浓度。如果离子浓度相差十分悬殊的情况下,离子浓度大的有可能先放电。如理论上H+的放电能力大于Fe2+、Zn2+,但在电解浓度大的硫酸亚铁或硫酸锌溶液时,由于溶液[Fe2+]或[Zn2+]>>[H+],则先在阴极上放电的是Fe2+或Zn2+,因此,阴极上的主要产物则为Fe和Zn。但在水溶液中,Al3+、Mg2+、Na+等是不会在阴极上放电的。
|
电解池 |
|
有外接电源 |
|
两个电极;有外接电源;有电解质溶液 |
|
阴极:与电源负极相连 阳极:与电源正极相连 |
|
阴极:本身不反应,溶液中阳离子得电子发生还原反应。 阳极:发生氧化反应,若是惰性中极,则是溶液中阴离子失电子;若是非惰性电极,则电极本身失电子 |
电源负极 阴极,阳极 阴极,阳极 电源正极 电源正极 |
|
电能→化学能 |
14.(10分)(2003年春季高考题)取标准状况下CH4和过量O2的混合气体840 mL,点燃,将燃烧后的气体用过量碱石灰吸收,碱石灰增重0.600 g,计算:
(1)碱石灰吸收后所剩气体的体积(标准状况)。
(2)原混合气体中CH4和O2的体积比。
13.(15分)化学上常用燃烧法确定有机物的组成。这种方法是在电炉上加热纯O2氧化管内样品,根据产物的质量确定有机物的组成。下图所列装置是用燃烧法确定有机物分子式的常用装置。
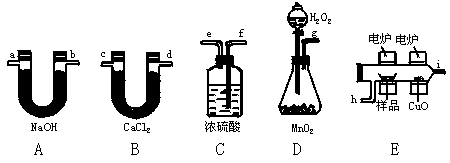
回答下列问题:
(1)若产生的O2按从左到右的流向,则所选装置各导管的连接顺序是 。
(2)装置C中浓H2SO4的作用是 。
(3)装置D中MnO2的作用是 。
(4)燃烧管中CuO的作用是 。
(5)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物的最简式是 。
(6)若要确定该有机物的分子式,则还需要 。
12.(10分)在1.01×105Pa、120℃时,1 L A、B两种烷烃组成的混合气体,在足量O2中充分燃烧后,得到同温同压下2.5 L CO2和3.5 L水蒸气,且A分子中比B少2个碳原子,试确定A和B的分子式及体积比。
11.(10分)下图是德国化学家李比希1831年测定烃类化合物(只含C、H两元素)组成的装置。瓷舟内的烃样品经加热分解或气化后用纯O2流驱赶经过红热的CuO,这里烃类化合物反应变成CO2和H2O,再经吸收管吸收。已知下表数据。
|
瓷舟 |
吸收管Ⅰ |
吸收管Ⅱ |
|||
|
小舟 |
样品+小舟 |
吸收前 |
吸收后 |
吸收前 |
吸收后 |
|
A mg |
B mg |
C mg |
D mg |
E mg |
F mg |
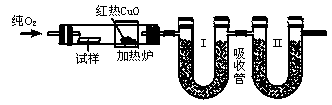
(1)烃样品在反应过程中所用的氧化剂是 。
(2)吸收管Ⅰ应装的吸收剂是 ,Ⅱ应装的吸收剂是 。
(3)样品中碳的质量分数的数学表达式是 。
10.(10分)按系统命名法填写下列有机物的名称及有关内容:
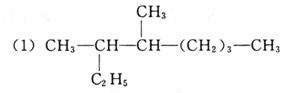
名称是 ,它的一卤代物有 种同分异构体;
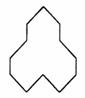
(2) 名称是 ,1 mol该烃完全燃烧需消耗O2 mol。
9.已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如下图:
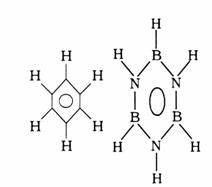
则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为
A.2 B.3 C.4 D.6
8.某植物中(C6H10O5)n的含量为10%,若在一定条件下,微生物将(C6H10O5)n转化成CH4:
(C6H10O5)n+nH2O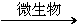 3nCH4↑+3nCO2↑
3nCH4↑+3nCO2↑
某沼气池,当加入该植物162 kg,可得CH4在标况下的体积为
A.6.72 m3 B.6.72 L
C.2.24 m3 D.4.48 m3
7.1,2,3-三苯基环丙烷的3个苯基可以分布在环丙烷平面的上下,因此有如下2个异构体。
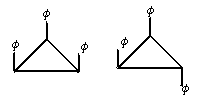
( 是苯基,环用键线表示,C、H原子都未画出)
是苯基,环用键线表示,C、H原子都未画出)
据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数是
A.4 B.5 C.6 D.7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com