
题目列表(包括答案和解析)
3、将3.9g镁铝合金,投入到500mL2mol/L的盐酸中,金属完全溶解,再加入4mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是
A、125mL B、200mL C、250mL D、560mL
2、常温下对pH=10的NaOH溶液和pH=4的HCl溶液中水的电离程度比较,下列叙述正确的是 A、前者大 B、后者大 C、两者相等 D、无法确定
1、对pH=3的醋酸溶液和pH=3的HCl溶液等体积混和后,溶液的PH值
A、PH<3 B、PH>3 C、PH=3 D、无法确定
10.钠在空气中燃烧(下左图)生成产物的固体物质中除有黄色粉末外,还有黑色固体物质--碳。
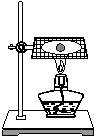

(1)请假设黑色固体物质可能产生的原因是:
假设① ;
假设② ;
假设③ 。
(2)为确认以上其中一种假设的正误,某同学进行如下推断:由于金属钠与氧的结合能力比碳强,因此黑色碳可能是二氧化碳与金属钠发生置换反应而生成。该同学设计实验如下:
甲打孔器钻取一段金属钠,取中间一小块钠放在充满二氧化碳气体的试管(上右图)中加热,观察到钠燃烧发出黄色火焰,并有黄色固体和黑色固体生成,生成的黄色固体立即变成白色。请回答下列问题:
①用打孔器这种方法取金属钠的原因是 ;
②产生以上现象的可能的化学反应方程式为: 。
答案:(1)①金属钠上没有擦干净的煤油不完全燃烧后生成碳,②酒精不完全燃烧生成的碳;③酒精燃烧产生的二氧化碳与金属钠反应生成的碳;④金属钠中含有杂质;⑤金属钠中的杂质反应后的生成物等(要求填三种即可)。
(2)①保证所取的是纯净的钠
②2Na+CO2 点燃 C+Na2O2,
2Na2O2+2CO2 点燃 2Na2CO3 +O2,或
Na2O2+2Na 点燃 2Na2O
9.当前,一次性筷子、一次性饭盒的安全也受到社会的关注。专家介绍说,正规的一次性筷子所用的原料都是质地较好的木材,不用特殊加工。但是很多小作坊为了降低成本,使用劣质木材,为筷子看上去白一些,他们常用硫磺进行熏蒸漂白,结果造成二氧化硫严重超标,同时硫磺中含铅、汞等重金属,也会对人体造成铅中毒或汞中毒。
(1)“硫磺熏蒸”是应用二氧化硫的漂白性质,写出硫磺燃烧的化学方式
___________________________________________
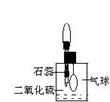 (2)防止、减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,减少二氧化硫的含量。为研究SO2的溶解性质,某学生做如下实验:如右图,集气瓶中收集的是SO2,瓶塞系着瘪气球,向瓶中滴加紫色石蕊试液,实验现象是________。为比较SO2 和CO2溶解性的大小,某学生采取同样的装置和操作,能说明SO2在水中的溶解性大于CO2在水中溶解性的实验现象是____________。某学生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为_______,接着向溶液中加入足量氯水,实验现象为_______,再滴加BaCl2溶液,实验现象为_____________。
(2)防止、减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,减少二氧化硫的含量。为研究SO2的溶解性质,某学生做如下实验:如右图,集气瓶中收集的是SO2,瓶塞系着瘪气球,向瓶中滴加紫色石蕊试液,实验现象是________。为比较SO2 和CO2溶解性的大小,某学生采取同样的装置和操作,能说明SO2在水中的溶解性大于CO2在水中溶解性的实验现象是____________。某学生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为_______,接着向溶液中加入足量氯水,实验现象为_______,再滴加BaCl2溶液,实验现象为_____________。
(3)在制一次性筷子时有“抛光”程序:加入滑石粉和木签一起搅拌,起到干燥、打磨的作用,使筷子变得光滑,以免毛疵划人的口腔。已知滑石粉是一种含水的具有层状结构的硅酸盐矿物。其质量组成为MgO 31.88%,SiO2 63.37%,H2O 4.75%,其化学式为 。
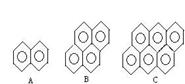 (4)有的厂家用石蜡代替“滑石粉抛光”,石蜡是含碳原子数(C20-C30)较多的稠环芳香烃,常温下为固体,温度高时熔化后可随食物进入人体致使慢性中毒。有如右的一系列物质,则A的分子式为 ,A、B、C 可以互称同系物吗?为什么?_____________?该系列化合物里碳的最大质量分数为
? 若E是A的一个氢原子被羟基取代的产物,预测E可能具有哪些化学性质(至少举2条)
(4)有的厂家用石蜡代替“滑石粉抛光”,石蜡是含碳原子数(C20-C30)较多的稠环芳香烃,常温下为固体,温度高时熔化后可随食物进入人体致使慢性中毒。有如右的一系列物质,则A的分子式为 ,A、B、C 可以互称同系物吗?为什么?_____________?该系列化合物里碳的最大质量分数为
? 若E是A的一个氢原子被羟基取代的产物,预测E可能具有哪些化学性质(至少举2条)
|
答案:(1)S+O2=SO2
(2)紫色石蕊试液变红、气球鼓胀起来 SO2溶解时气球鼓胀的程度大于CO2溶解时气球的鼓胀程度 品红溶液的红色褪去(品红、SO2结合成不稳定的化合物),溶液显浅紫色(石蕊的颜色) 先变红后褪色(足量氯水能氧化SO2、石蕊和品红试液) 生成白色沉淀(BaSO4)。
(3)Mg3(Si4O10)(OH)2
(4)C10H8 。不能,因为A、B、C 相差n个C6H2,不是n个CH2。解析:(4)因该系列化合物的通式为C6n+4H2n+6(n≥1),用数学极限思想求得C﹪的最大值为 97.3﹪。根据题意知E是C10H7-OH,应具有与苯酚相似的化学性质,可推测E能与溴水发生取代反应、E与FeCl3能发生显色反应、 E能和碳酸钠溶液反应等。
8.2007年1月30日湖北107国道湖北孝感段发生危险化学品泄漏, 上百人中毒,1人死亡.经公安部门侦查及卫生部门医学诊断,判断为高毒类有机物硫酸二甲酯泄漏引发的人员中毒。该物质在有机合成中用作甲基化试剂(提供-OCH3)。但随着对此研究的深入,该有毒物质的应用范围越来越小,相信不久将被无毒的有机物M完全取代.
现有一种有机香料A是经过有机物M作为甲基化试剂合成的(注意:取代基不能全部相邻)。
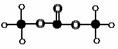
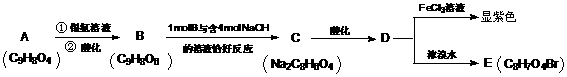
(1)有机物M结构的球棍模型如图所示:
有机物M的分子式为: 名称为 ,
写出M在氢氧化钠溶液中反应的化学方程式: ;
(2)A分子中的官能团的是 ;(除甲氧基外)
(3)根据上述信息 (填可以或不能)确定A的结构式,理由是 ;
(4)A可以发生的反应是 (填符号);
a 还原反应 b氧化反应 c 酯化反应 d水解反应
(5)写出符合下列要求的A的同分异构体共有 种;
①含有苯环 ②能发生银镜反应 ③1mol该异构体能与2molNa反应
④苯环上只能生成三种一氯代物
(6)写出下列反应的化学方程式(有机物用结构简式表示),且指出反应类型。
A → B:
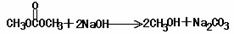 D → E:
D → E:
答案:(1)C3H6O3; 碳酸二甲酯;
(2)醛基 ;酯基 (3)不能;两个取代基与酚羟基的位置有两种
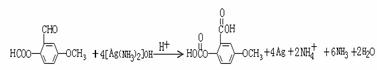
(4)b d
(5) 10 (6)
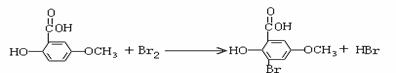 氧化反应
氧化反应
取代反应
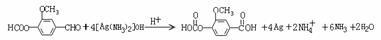 或者:
或者:
7.中央电视台新闻栏目2006年5月14日报道齐齐哈尔第二制药有限公司生产的假药事件, “齐二药”违反规定,购入工业用“二甘醇”代替医用丙二醇(C3H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇,造成多名患者死亡。二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,其主要产品有吗啉及其衍生物1,4-二恶烷(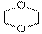 )等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛。二甘醇一般的合成路线为:
)等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛。二甘醇一般的合成路线为:



|
① ② ③ ④
请回答下列问题:
(1)下列关于“丙二醇”和“二甘醇”及“乙二醇”的有关说法正确的是
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程Ⅰ是石油加工中常用步骤,其名称为 。
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,则为了能得到二甘醇D,物质B到物质C的反应条件是 ,该反应属于 (添反应类型)。写出B可能生成E的化学方程式: 。
(4)物质D是二甘醇,则合成路线中的物质A、B、C的结构简式分别是:
A: B: C:
(5)反应Ⅲ的化学方程式为: 。
(6) 写出二甘醇制备1,4-二恶烷的化学方程式: 。
答案:(1)A (2)裂解;(3)NaOH水溶液,取代反应;

CH2BrCH2Br + 2NaOH HC≡CH↑+ 2 NaBr (3分)
(4) A:CH2=CH2,B:Br-CH2-CH2-Br,C:HO-CH2-CH2-OH。(各1分共3分)
(5)2HO-CH2-CH2-OH 2HO-CH2-CH2-O-CH2-CH2-OH+H2O(3分)
2HO-CH2-CH2-O-CH2-CH2-OH+H2O(3分)
(6)HO-CH2-CH2-O-CH2-CH2-OH
 +H2O (3分)
+H2O (3分)
解析:本题涉及到石油的裂解、有机反应类型、有机反应条件的选择等方面的知识。从产物可以看出本题的物质的转化关系,从而容易得到有机物的结构简式。D是HO-CH2-CH2-O-CH2-CH2-OH,C为HO-CH2-CH2-OH,B为Br-CH2-CH2-Br,A为CH2=CH2。知道了具体的物质其他问题就可以解决。
6.在一定条件下,可实现下列物质间的转化,转化过程如下图所示,
请回答相关问题:

(1)固体A是一种重要的工业原料,其化学式为 。
(2)利用上图中的物质实现 C到B转化过程的离子方程式是 。
(3)上述变化过程中生成的C和丙恰好能完全反应,该反应的化学方程式为:
。
(4)若甲和乙恰好完全反应,则W和A的物质的量之比是 。
解析:本题的框图主要由三个反应组成,很自然地把无机物的转化和有机物的转化进行了融合。类似的情况在近几年的高考中有所体现,所融合的有机反应主要是烃的燃烧,卤代等。
本题的突破口很多,从物质的颜色状态来看有:淡黄色固体W和悬浊液C;从反应特征来看有:两个与H2O反应放出气体的反应特征;从提示信息来看有:设问(1)中的固体A是一种重要的工业原料……可以综合分析从而提出假设。
答案:(1)CaC2 ;(2)Ca(OH)2 + CO = CaCO3 + 2OH- (3)Ca(OH)2 + 2CO2 = Ca(HCO3)2 (4)5 : 1
3.市场上出售的“热敷带”的主要成分是铁屑、碳粉、木屑、少量的氯化钠、水等。“热敷带”启用之前用塑料袋密封,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会产生大量铁锈。
(1)“热敷带”放热的原理是:______________________________________________
(2)碳粉的作用是: 氯化钠的作用是:_____________________________
(3)有关电极反应是:________________________________________________________
总反应为:_____________________________________________________________
答案: 1利用原电池原理
2充当原电池的正极;充当原电池的电解质溶液
3正极:2H2O+O2+4e-=4OH_ 负极:Fe-2e-=Fe2+
总:4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe(OH)3=Fe2O3+3H2O
4:甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是___________________________________________________。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:____________________________________________________。
(3)在一定条件下,甲与O2反应的化学方程式是:______________________。
(4)丁的元素符号是____,它的原子结构示意图为_________________________。
(5)丁的氧化物的晶体结构与______的晶体结构相似。
[答案](1)CaC2 + 2H2O ===Ca(OH)2 + C2H2↑

 (2)Fe2O3
+3CO
(2)Fe2O3
+3CO 2Fe
+ 3CO2
2Fe
+ 3CO2
(3)N2 +O2 2NO (4)Si ;(5)金刚石
解析:本题是一道综合性很强的推断题,它以等电子微粒结构与性质有机结合起来有效的考查综合分析能力,同时具有一定的开放性(填CO的用途)。解答本题的突破口是“丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体”,而丙为负二价双原子的离子,且电子总数为14,根据中学化学课本上介绍的两种负二价阴离子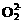 和
和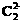 ,可知丙为
,可知丙为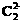 。电子总数为14的原子是硅原子。由相同元素组成的双原子分子为N2。乙在高温下是一种还原剂且为14个电子,则乙为CO,CO在工业上主要是冶炼金属如炼铁等。
。电子总数为14的原子是硅原子。由相同元素组成的双原子分子为N2。乙在高温下是一种还原剂且为14个电子,则乙为CO,CO在工业上主要是冶炼金属如炼铁等。
5:室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请回答:
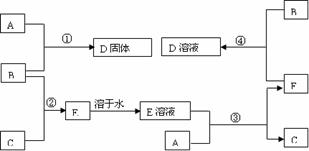
(1)A是______B是______C是______(请填写化学式)
(2)反应①的化学方程式为:____________________________________________。
(3)反应③的化学方程式为:____________________________________________。
(4)反应④的化学方程式为:____________________________________________。
[答案](1)Fe 、Cl2 、H2; (2)2Fe + 3Cl2 ==2FeCl3;
(3)Fe + 2HCl ==FeCl2 + H2↑; (4)2FeCl2 + Cl2 ==2FeCl3
解析:由B为黄绿色气体且为单质,可知B为Cl2;由框图可知反应①中生成的固体D为固体单质A与Cl2反应生成的一种氯化物;反应②中生成的E为Cl2与气体单质C 生成的一种可溶于水的氯化物,且E溶液和固体单质A又可以重新生成气体C和F,只有当C为H2,F为一种氯化物时才能满足这一过程;而A与Cl2反应已生成了一种氯化物D,F又是一种氯化物,所以A为变价金属,应为Fe。
2、有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的元素。
(1)A的名称是____________,B位于周期表中第_________周期________族,C的原子结构示意图是________________。
(2)E的单质颜色是____________________。
(3)A元素与D元素形成化合物的电子式是__________________。
(4)G的单质与水反应的化学方程式是______________________________。
(5)F的元素符号是_____________________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是_________,酸性最强的化学式是_______________,气态氢化物最稳定的化学式是______________。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是:___________________________________________。
解析:此题必须根据原子结构,元素周期表的知识,结合相关已知条件,并利用短周期元素原子结构的特征规律以及某些元素的特征性质,才能推算出原子序数,判定元素在周期表中的位置。进而顺利作答本题。此题综合性较强,考察的知识面较广,在高考试题中经常出现。这就要求学生在复习的过程中,必须注意知识间的相互联系。具体解答为:
据①知A、B、C均为第3周期的金属元素(只有Na、Mg、Al),且原子半径A>B>C,则A、B、C分别为Na、Mg、Al;据②可知D、E均为VIIA族元素,D的单质为液体,则D为Br,E的单质为固体,则E为I;
据③知F为He,据④知G为氟。
答案:(1)钠 3
ⅡA 
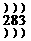 (2)紫黑色
(3)
(2)紫黑色
(3)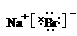
(4)2F2+2H2O 4HF+O2(5)He (6)NaOH HBrO4 HF
4HF+O2(5)He (6)NaOH HBrO4 HF
(7)Al(OH)3+OH- AlO2-+2H2O
AlO2-+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com