
题目列表(包括答案和解析)
7.nmolN2和nmol14CO相比较,下列叙述中正确的是 ( )
A. 在同温同压下体积相等 B. 在同温同压下密度相等
C. 在标准状况下质量相等 D. 分子数相等
6.设阿伏加德罗常数为NA,标准状况下,某种O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同条件下所占的体积(L)应是 ( )
A. 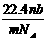 B.
B.
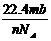 C.
C.
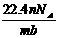 D.
D.
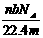
5.设NA表示阿伏加德罗常数,下列说法正确的是 ( )
A. 1L1mol/L的Na2CO3溶液中含CO32- 0.1NA
B. 标准状况下,22.4LSO3含分子数为NA
C. 常温下100mL0.1mol/L醋酸溶液中含醋酸分子0.01NA
D. 0.1molNa2O2与足量水反应转移电子数0.1NA
4.在反应X+2Y==R+M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR,则此反应中Y和M的质量之比为 ( )
A. 16:9 B. 32:9 C. 23:9 D. 46:9
3.质量为25.4g的KOH和KHCO3混合物先在250℃加热,冷却后发现混合物质量损失4.9g,则原混合物中KOH和KHCO3的组成为 ( )
A. 物质的量 KOH=KHCO3 B. 物质的量 KOH>KHCO3
C. 物质的量 KOH<KHCO3 D. KOH< KHCO3的任意比
2.现有A、B、C三种化合物,各取40g相混合,完全反应后,得B18g,C49g,还有D生成。已知D的式量为106。现将22gA和11gB反应,能生成D ( )
A. 1mol B. 0.5mol C. 0.275mol D. 0.25mol
1.根据化学反应A+B==C+D中,某学生作了如下四种叙述:①若mgA与B充分反应后生成ngC和wgD,则参加反应的B的质量为(m+n-w)g;②若mgA和ngB完全反应,生成的C和D的总质量是(m+n)g;③若取A、B各mg,则反应生成C和D的质量总和不一定是2mg;④反应物A、B的质量比一定等于C、D的质量比 ( )
A. ①②③ B. ②③④ C. ①④ D. ②③
[例7] 将4g甲烷和适量氧气混合后通入一密闭容器中,点燃使之恰好完全反应,待恢复到原温度后,测得反应前后压强分别为3.03×105Pa和1.01×105Pa,同时又测得反应共放出222.5kJ热量。试根据上述实验数据,写出该反应的热化学方程式。
[解析]书写热化学方程式有两个注意事项:一是必须标明各物质的聚集状态,二是注明反应过程中的热效应(放热用“+”,吸热用“-”)。要写本题的热化学方程式,需要解决两个问题,一是水的状态,二是反应过程中对应的热效应。由阿伏加德罗定律的推论可知: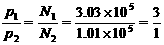 ,根据甲烷燃烧反应的化学方程式可知,水在该状态下是液体(想一想,如为气体则反应前后的压强比应为多少?),因4g甲烷燃烧时放出222.5kJ热量,则1mol甲烷燃烧时放出的热量为
,根据甲烷燃烧反应的化学方程式可知,水在该状态下是液体(想一想,如为气体则反应前后的压强比应为多少?),因4g甲烷燃烧时放出222.5kJ热量,则1mol甲烷燃烧时放出的热量为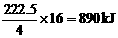 。
。
本题答案为:CH4(气)+2O2(气)==CO2(气)+2H2O(液)+890kJ
4.实战演练
[例6]1体积SO2和3体积空气混合后,在450℃以上通过V2O5催化剂发生如下反应:2SO2(气)+O2(气) 2SO3(气),若在同温同压下测得反应前后混合气体的密度比为0.9:1。则反应掉的SO2是原有SO2的___________%。
2SO3(气),若在同温同压下测得反应前后混合气体的密度比为0.9:1。则反应掉的SO2是原有SO2的___________%。
[解析]由阿伏加德罗定律的推论可知: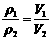 ,V2=0.9×(3+1)=3.6体积。
,V2=0.9×(3+1)=3.6体积。
设参加反应的SO2为x体积,由差量法
2SO2
+ O2 2SO3 ΔV
2SO3 ΔV
2 3-2=1
x 4-3.6=0.4
2:1=x:0.4 解得x=0.8体积,所以反应掉的体积是原有SO2的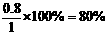 。
。
[例5]在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时压强增加了75%。则A单质的一个分子中有_______个A原子,AH3分解反应的化学方程式为__________________________________________。
[解析]由阿伏加德罗定律的推论:相同温度和压强时,p1/p2=N1/N2得反应前后气体的分子数之比为1:1.75=4:7,可理解为反应式左边气体和反应式右边气体系数之和的比为4:7,再按氢原子守恒不妨先将反应式写为4AH3==A( )+6H2,再由A原子守恒得A右下角的数字为4。
本题答案为:4,4AH3==A4+6H2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com