
题目列表(包括答案和解析)
15.将3.20gCu跟30.0mL10.0mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a molH+,则被还原的HNO3物质的量是
A.0.5a mol
B.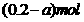 C.
C.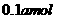 D.
D.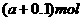
2009届高三年级化学补弱(三)答案
1-5:BBBCC 6-10:AACB①④⑤、③⑥
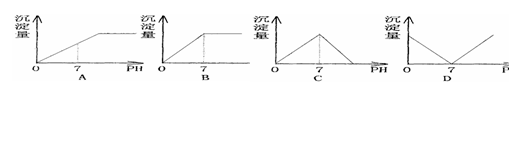
14.向盛有NaHSO4溶液的烧杯中不断滴加Ba(OH)2溶液,随着Ba(OH)2的不断滴入,溶液中产生的沉淀量与溶液的pH变化情况正确的是 ( )
13、向100mL含有等物质的量的NaCN、NaSCN和NaI混合液中滴入0.1mol液溴后,测得有一半CN-已被氧化,则原溶液中NaSCN的物质的量浓度为多少?
(已知①还原性I->SCN->CN->Br- ②SCN- 和CN-的氧化产物为(SCN) 2和(CN) 2):
A.4mol/L B.2mol/L C.1mol/L D.0.8mol/L
12.(10分)将化学知识系统化,有助于对化学问题的进一步认识。请你参与下列关于化学
 反应的讨论。
反应的讨论。
问题1:从不同的角度,化学反应可以有不同的
分类方法,不同类别的化学反应间又有一定的联
系,请在右图的方框中,用图示(每个圆圈代表
一类反应)的方法表示离子反应、化合反应和氧
化还原反应之间的关系。
问题2:不同化学反应进行的快慢和程度千差万别。反应的快慢和程度是化工生产考虑的两个重要因素。请你按照表中要求完成下表(填写内容不能重复)
|
序号 |
实际生产中采取的措施 |
工业生产实例(各写1个化学方程式) |
|
(1) |
通过增大压强提高原料转化率 |
|
|
(2) |
使用催化剂增大反应的速率 |
|
|
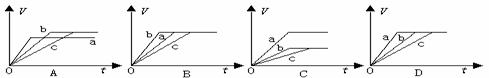
11、等质量的三份锌a、b和c,分别加入稀H2SO4中,a中同时加入适量CuSO4溶液,c中加入适量CH3COONa。下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中可能正确的是 ( A )
10.某无色溶液中只可能含有①Na+ 、②Ba2 +、 ③Cl一、 ④Br一、⑤SO32一、⑥SO42一 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
|
肯定含有的离子是 ,不能确定的离子是
8.下列实验方案可行的是
A.鉴别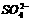 加入BaCl2溶液,再加稀盐酸,观察沉淀是否消失
加入BaCl2溶液,再加稀盐酸,观察沉淀是否消失
B.证明 中一定有碳碳不饱和键:滴人KMnO4酸性溶液,看紫红色是否褪去
中一定有碳碳不饱和键:滴人KMnO4酸性溶液,看紫红色是否褪去
C.量取14.80mLlmol·L-1NaOH溶液:选用25mL碱式滴定管
D.检验溶液中一定有CO32-加入稀盐酸,将产生的气体通人澄清石灰水
|
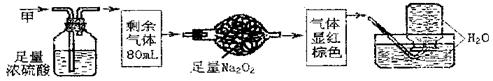 9.无色的混合气体中,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成为( )
9.无色的混合气体中,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成为( )
A.NH3、NO2、N2 B.NH3、NO、CO2 C.NH3、NO2、CO2 D.NO、CO2、N2
7. 将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用l mol·L-1。的盐酸滴定,至沉淀质量最大时,消耗盐酸40 mL,原合金中钠的质量为
A.0.46 g B.0.69 g C.0.92 g D.0.23 g.
6.以下物质的制备原理错误的是( )
A. 无水氯化镁的制备
:MgCl 2·6H2O MgCl2+ 6H2O
MgCl2+ 6H2O
B. 钴的制备:3Co3O4+8Al 9Co+4Al2O3
9Co+4Al2O3
C. 烧碱的制备:2NaCl+2H2O 2NaOH +H2↑+ Cl2↑
2NaOH +H2↑+ Cl2↑
D. 漂粉精的制备: 2Ca(OH)2+ 2Cl2→Ca(ClO)2 +CaCl2+2H2O
5.利用下列各组物质制备和收集气体,能采用右图装置的是( )
A. 浓氨水与生石灰反应制NH3 B. 浓盐酸与二氧化锰反应制Cl2
C. 过氧化氢溶液与二氧化锰反应制O2 D. 电石与饱和食盐水反应制C2H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com