
题目列表(包括答案和解析)
4.以下关于一些最新合成的新物质的性质分析,你认为合理的是( )
A.中国科学院,已成功研制出具有良好的超导性的球碳盐K3C60,该物质很有可能属于离子晶体,因此该盐中应既有离子键,又有极性共价键。
B.厦门大学郑兰荪院士合成了C50Cl10富勒烯足球状分子,该分子的相对分子质量为955,分子中共用电子对数目为105个。
 C.意大利科学家合成了一种新型氧分子,它是由4个氧原子构成的 O4(
C.意大利科学家合成了一种新型氧分子,它是由4个氧原子构成的 O4(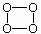 )分子,分子中每个原子均达到8e一稳定结构,4个氧原子一定在一个平面内。
)分子,分子中每个原子均达到8e一稳定结构,4个氧原子一定在一个平面内。
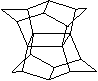
D.1983年,福瑞堡大学的普林巴克合成的多环有机分子又称庙宇烷,
该物质应为饱和烃,其分子式为C20H20,一氯代物的同分异构体有3种。
3.下列说法正确的是( )
A、VIIA族的两种元素X、Y,若X的非金属性比Y强,则其原子序数之差可能为44,且X单质一定能从NaY溶液中置换出Y
B、位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的最高化合价X<Y
C、若Z元素的阴离子与同一周期的稀有气体元素原子的电子层结构相同,则Z一定为主族元素
D、短周期非金属元素X和Y能形成XY2型化合物,则XY2一定为分子晶体
2.二元酸H2A在水中发生电离:H2A H++HA-和HA-
H++HA-和HA- H++A2-,则下列物质的水溶液中存在的关系式不正确的是
H++A2-,则下列物质的水溶液中存在的关系式不正确的是
A.NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.NaHA:c(Na+)= c(A2-)+ c(HA-)
C.Na2A:c(Na+)> c(A2-)>c(OH-)>c(H+)
D.H2A:c(H+)= c(HA-)+ 2c(A2-)+ c(OH-)
1.常温下Ca(OH)2溶于水达饱和时存在如下平衡:
Ca(OH)2(s)
Ca(OH)2(aq),Ca(OH)2(aq) Ca2++2OH-
饱和石灰水的密度为d
g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为
A.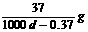 B.
B.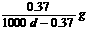 C.
C.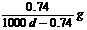 D.
D.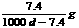
34.金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是 ( )
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
33. 有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3,则下列叙述正确的是 ( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C.电池工作过程中,SOCl2 被还原为Li2SO3
D.电池工作过程中,负极消耗锂与正极区析出的S的质量之比为7:8
32. 某同学按右图所示的装置进行电解实验。下列说法正确的是( )
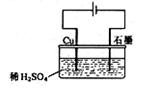 A.电解过程中,铜电极上有H2产生
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度一直会不断增大
31. LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 负极 Li-e-== Li+
下列说法中正确的是
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时,在正极上是Li+得电子被还原
D.放电时电池内部Li+向负极移动
30.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是
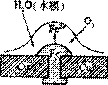 A.负极电极反应式为:Fe-3e-=Fe3+
A.负极电极反应式为:Fe-3e-=Fe3+
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀 D.此过程中电子从Fe移向Cu
29.某溶液含有NaCl和H2SO4两种溶质,它们的物质的量之比为2∶1。用石墨作电极电解该混合溶液时,根据电极产物,可明显地分为二个阶段。下列叙述中错误的是
A.阴极始终只析出H2 B.阳极先析出Cl2,后析出O2
C.电解的最后阶段是电解水 D.溶液的pH不断增大,最后pH大于7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com