
题目列表(包括答案和解析)
3、已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气。测得产物中NO2与O2的体积比为6∶1(同温同压下测得),试分析该硝酸盐分解时金属化合价的变化情况是
A、升高 B、降低 C、不变 D、不能确定
2、下列分子的电子式书写正确的是
A、氨  B、四氯化碳
B、四氯化碳 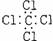 C、氮
C、氮 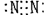 D、二氧化碳
D、二氧化碳 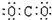
1、下列变化属于物理变化的是
A、煤的干馏 B、纯碱的风化 C、丁烷的裂化 D、石油的分馏
1..⑴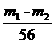 ×132 ⑵①除去铁屑表面的油污 加快过滤速率,防止FeSO4被氧化;趁热过滤防止FeSO4从溶液中析出 ②浓缩至液体表面出现洁净薄膜 ③标准色阶和待测液的浓度相当 ④将待测液与标准色阶的红色进行比较后确定
×132 ⑵①除去铁屑表面的油污 加快过滤速率,防止FeSO4被氧化;趁热过滤防止FeSO4从溶液中析出 ②浓缩至液体表面出现洁净薄膜 ③标准色阶和待测液的浓度相当 ④将待测液与标准色阶的红色进行比较后确定
(每空2分,共12分)
(1)(2分)Cu + 4H+ + 2NO3- = Cu2+ + 2 NO2↑+ 2H2O。 (2)(2分)①可以控制反应、②吸收NO2气体,防止污染环境。 (3)(3分)c;a、b。 (4)(2分)先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)②试管。(合理答案均给分)(5)(3分)1/22.4 mol·L-1 (无单位扣1分)
2.(13分)
(1)(4分)方案1不合理(1分),因为铜和氧化亚铜均可溶于稀硝酸形成蓝色溶液(1分);方案2合理(1分),因为氧化亚铜与稀硫酸生成Cu和Cu2+,导致溶液呈蓝色(1分)
(2)(3分)c<(9b-a)/8(2分) 4(1分)
(3)(3分)关闭导气管上的活塞(1分),从分液漏斗中往试管中注水(1分),漏斗中的液面高度高于试管中的液面高度,说明气体发生装置气密性良好(1分)[合理方法同样给分]
(4)(3分)①②③
3[提出问题]与BaCl2溶液反应有沉淀生成
[实验探究]用玻璃棒蘸取Na2S2O3溶液,点滴到pH试纸的中央,将试纸呈现的颜色与标准比色卡对照 有淡黄色沉淀和无色刺激性气味气体产生
S2O32-+4Cl2+ 5H2O=2SO42-+8Cl-+10H+
[问题讨论]⑴不正确,因氯水过量,氯水中同样含有Cl- ⑵取少量反应后的溶液,向其中滴入氯化钡溶液,若观察到有白色沉淀产生,则说明Na2S2O3能被氯水氧化
(每空2分,共12分)
2009届高三化学实验题训练二
1.(10分)
(1)(2分)ABCD[填对2个给1分,全对2分]
(2)(8分)①(3分)是否所有金属在纯氧中燃烧都没有火焰?(1分) 取镁条、细铜丝(1分)用同样方法点燃伸入装纯氧的集气瓶,观察是否有火焰(1分)
②(4分)若为铁丝中含碳引起的(1分),应取细纯铁铁丝、细含碳铁丝分别在纯氧中点燃观察(1分);若所有金属丝在纯氧中燃烧都会火星四射(1分),则应同时取上述几种金属丝用砂子将表面打磨后分别在纯氧中燃烧观察现象(1分)
③(1分)燃烧时炭粒生成的气体CO2在熔融液态铁中形成气泡而炸裂
3.(12分)(1) 4(1分) (2) 避免Na2SO3被氧化(1分)2Na2SO3+O2=2Na2SO4(1分)
(3) 4Na2SO3 Na2S+3Na2SO4(2分)
Na2S+3Na2SO4(2分)
(4) 实验③的溶液中有Na2S,在相同条件下(1分),S2-水解程度大于SO32-(1分),溶液的碱性强,pH值较大(1分)
(5) 取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-(2分)另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-(2分)
2009届高三化学实验题训练二
2.(15分)
方法一:(2)取适量绿矾于小烧杯中(1分),加入煮沸后的水和少量稀H2SO4,(1分)并加入Fe粉,(1分)完全搅拌,过滤后将滤液移入细口试剂瓶(1分)。(3)苯(1分)
方法二:(1)H2、夹住铁夹(各1分)(2)因为Fe(OH)2是在H2的还原气氛中产生的。(2分)
方法三:(1)Fe-2e-=Fe2+(1分)(2)B(1分)(3)Fe+2H2O Fe(OH)2↓+H2↑(2分)
Fe(OH)2↓+H2↑(2分)
(4)隔绝空气,防止Fe(OH)2被氧化(1分)
(5)白色沉淀变为灰绿色,最终变为红褐色沉淀(1分)
1.(11分)步骤1:酒精灯、泥三角、坩埚、研钵(研杵)(每空1分,共4分)
步骤2:取最后一次洗涤液少许于试管中,滴加CaCl2溶液,若无沉淀产生,则已洗净。(2分,其他合理答案均给分),应该(1分)
步骤3:500.0mL容量瓶(1分),锥形瓶内溶液颜色变化。(1分)0.4%(或0.004)(2分)
2.下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
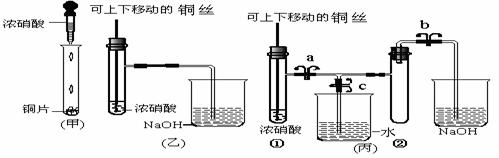
(1)铜和浓硝酸反应的离子反应方程式是 。
(2)和甲装置相比,乙装置的优点是 、
_ 。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹 __(填a或b或c),再打开弹簧夹 _ 和___ (填a或b或c),才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管。应如何操作
。
(5)当②试管中的NO2和水充分反应,所得溶液物质的量浓度的最大值是 。
(不考虑NO2与N2O4的转化且该实验条件为标准状况下)
2009届高三化学实验题训练一
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com