
题目列表(包括答案和解析)
1、下列描述中,符合化学科学的是
A、“曾青得铁则化为铜”中的“曾青”是指硝酸铜
B、“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
C、“玉不琢不成器”、“百炼方能成钢”的说法都与物质的化学变化无关
D、“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是指纤维素和油脂
29、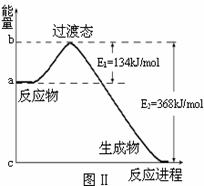 (9分) 1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(9分) 1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
 (2)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
(2)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/ kJ·mol–1 |
197 |
360 |
499 |
X |
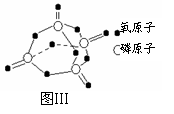
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结如图Ⅲ所示,则上表中X= 。
选做题
28、(12分) pH<7的溶液中含有三种常见金属阳离子,用x溶液进行如下实验:
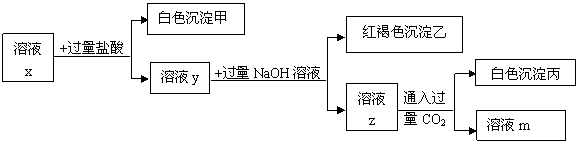
(1)根据有白色沉淀甲生成,判断x溶液中有 阳离子。
(2)根据有白色沉淀丙生成,判断x溶液中有 阳离子;由溶液z生成沉淀丙的离子方程式为 。
(3)x溶液中一定含有的阴离子是 。
(4)根据上述实验 (填“能”或“不能”)确定x溶液中的第3种金属阳离子,理由是 。
27、(19分) 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
① 甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含____________(填化学式,下同)所致。
② 乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_______所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液;b.CCl4; c.无水酒精;d. KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为______________________________。
(5)实验后的思考
① 根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是_______(填离子的化学式)。
② 在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量的浓度为_______________。
26、I(共14分)现有常温常压下等质量的二氧化硫和氧气混合,根据要求填写下列空格:
(1)分子数之比为 , (2)原子数之比为 ,
(3)氧原子数之比为 , (4)物质的量之比为 ,
(5)体积之比为 , (6)平均摩尔质量是 ,
(7)混合气体的密度对氢气的相对密度是 。
II (共6分) 6.4 g铜与过量硝酸(a mol/L,30 mL)充分反应,硝酸的还原产物只有NO2、NO。反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol
(2)求生成的气体中NO2和NO的物质的量各为多少(用含有a的式子表示)
8、下列离子方程式书写错误的是
A、在NH4HCO3溶液中加入含等物质的量NaOH的溶液:NH4++HCO3-+2OH-==CO32-+NH3↑+2H2O
B、Ca(HCO3)2在溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-==CaCO3↓+ CO32-+2H2O
C、氢氧化铁溶于氢溴酸中:Fe(OH)3+3H+==Fe3++3H2O
D、在Ba(OH)2溶液中通入过量CO2气体:OH-+CO2==HCO3-
7、NA为阿佛加德罗常数,下列说法错误的是
A 标准状况下的22.4 L苯完全燃烧,生成二氧化碳分子数为6NA
B 18g水中含有的电子数为10NA
C 46 g 二氧化氮和46 g四氧化二氮含有的原子数均为3NA
D 在1 L 2 mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
6、将标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1 L水中,所得溶液密度为ρ g/cm3,则此溶液的物质的量浓度(mol/L)为
A、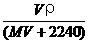 B、
B、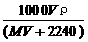 C、
C、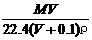 D、100VρM /(MV+2240)
D、100VρM /(MV+2240)
5、有5.12 g铜和一定质量的硝酸反应,当铜消耗完时,共收集到标准状况下的气体3.36 L,若把装有这些气体的集气瓶倒立在盛水的水槽中,需通入多少升标准状况下的氧气才能使集气瓶充满溶液。
A、0.336 L B、0.224 L C、0.896 L D、1.12 L
4、下列各组离子在指定的环境中能大量存在的是
A、在pH=1的无色溶液中:SO42-、Cu2+、Na+、Cl-
B、在能使石蕊试纸变蓝色的溶液中:Na+、K+、S2-、CO32-
C、在加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3-
D、由水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com