
题目列表(包括答案和解析)
3、设NA表示阿伏加德罗常数,下列说法正确的是( )
A.常温常压下,22.4L氖气含有NA个氖原子
B.1molNa2O2固体跟足量CO2气体完全反应,转移2NA个电子
C.1molCH3+含有8NA个电子
D.标准状况下,NA个SO2分子和NA个SO3分子的体积相同
2、为了消除NOx对大气的污染,工业上通常利用如下反应NOx+NH3→N2+H20来保护环境。现有NO2和NO的混合气体3L,可用相同状况下3.5L的NH3恰好使其完全转化为N2,则混合气体中NO2和NO体积之比为 ( )
A.1:4 B.3:1 C.2:1 D.1:l
1、从宏观方面来说物质由元素组成,从微观方面来说物质由粒子构成。下列说法中不正确的是( )
A.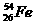 与
与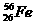 互为同位素
互为同位素
B.只由一种分子组成的物质一定为纯净物
C.质子数等于电子数的某微粒,可能是一种分子或一种离子
D.46gNO2和46gN2O4含有的原子数相等
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
BC |
C |
A |
AD |
A |
C |
AD |
C |
C |
B |
12.T °C时气体A与气体B反应生成气体C和固体D。每1 mol A与足量B完全反应时生成1 mol D。反应过程中A、B、C浓度变化如图①所示。若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图②所示。则下列结论正确
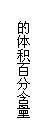 的是
的是
 A.该反应的化学方程式是
A+3B 2C+D A.该反应的化学方程式是
A+3B 2C+DB. T°C若向上述平衡体系中加入0.2 mol C,平衡时A的浓度大于0.3 mol/L C.升高温度,其它条件不变时,,正、逆反应速率均增大,且A的转化率增大 D.相同时间内,消耗0.1 mol/L A时,生成了0.3 mol/L B,反应达到平衡 13.二元酸H2A在水中发生电离:H2A=H++HA-和HA- 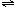 H++A2-,则下列几种物质的水溶液中关系式不正确的是
( ) H++A2-,则下列几种物质的水溶液中关系式不正确的是
( )A.NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+) B.NaHA:c(Na+)=c(A2-)+c(HA-) C.Na2A:c(Na+)>c(A2-) >c(OH-)>c(H+) D.H2A:c(H+)=c(HA-)+2 c(A2-)+c(OH-) 14.常温下,下列各组离子在指定环境下能大量共存的是 A.pH=l的溶液中:Na+、K+、SO32-、MnO4- B.pH=7的溶液中:Na+、A13+、Cl-、SO42- C.pH>12的溶液中:Na+、K+、SO42-、AlO2- D.pH=0的溶液中:Na+、K+、NO3-、ClO- 15.下列反应的离子方程式书写正确的是 A.小苏打溶液与氢氧化钠溶液反应:HCO3-+OH-=CO32-+H2O B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性: Ba2++OH-+H++SO42-=BaSO4↓+H2O C.氧化亚铁溶液中滴加稀硝酸:Fe2++NO3-+2H+=Fe3++NO↑+H2O D.偏铝酸钠水解:AlO2-+2H2O  Al(OH)3↓+OH- Al(OH)3↓+OH-16.短周期元素A、B、C、D的原子序数依次增大,它们的原子最外层电子数之和为17,其中A、C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是 ( ) A.最高价氧化物对应的水化物的酸性:A<C<D B.A的氢化物的稳定性小于C的氢化物 C.原子半径:B>C>D D.A与D可形成离子化合物 17.镁铝合金5.1 g溶于300 mL2 mol/L的盐酸,在标准状况下放出气体的体积为5.6 L。向反应后的溶液中加入足量氨水,产生沉淀的质量为 A.5.1g B.10.2g C.13.6g D.15.3g 18.将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后得到的固体,经测定Na2O2无剩余,则最后固体的物质的量为 ( ) A.1-2mol之间 B.1-4mol之间 C.2-4mol之间 D.大于4mol 答案 一、选择题(本题包括8小题,每小题4分,共32分)
11.某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为 A.11.2 g B.16.8 g C.19.6 g D.22.4 g 10.现有pH=a和pH=b的两种HCl溶液,已知b=a+2,将两种溶液等体积混和后,所得溶液的pH接近于 ( ) A. a-lg2 B. b-lg2 C. a+lg2 D. b+lg2 9.铝、铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是 A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 D.BeCl2水溶液的导电性强,故BeCl2是离子化合物 8. 25℃时,将两铜电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,阴极析出了a mol气体,同时有W gNa2SO4•10H2O晶体析出,温度不变时剩余溶液中溶质的质量分数为 A.
C. D. 7.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆--氧化钇为电解质,这种固体电解质在高温下允许氧离子(
A.有氧气进入发生反应的a极为电池的负极 B.有氢气进入发生反应的b极为电池的正极 C.a极对应的电极反应为: D.该电池的总反应方程式为: 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |