
题目列表(包括答案和解析)
6.[答案]C
[分析预测及备考建议]氧化还原反应中的氧化剂、还原剂等的判断都是高考每年考查的热点。
[答题技巧] H37Cl的溶液跟K35ClO3晶体在一定条件下充分反应生成氯气、氯化钾和水的方程式为:6H37Cl + K35ClO3 = 3Cl2 + KCl + 3H2O,而3Cl2的式量应是5×37+35=220,则氯气的式量为:220÷3=73.33。
5.[答案]D
[分析预测及备考建议]绿色化学是近年的热门,不再局限于原子利用率了,将生产、生活中的环境问题也纳入其中,即怎样通过化学改变生活,同时改善环境等,也在不断探索。
[答题技巧]A项中对垃圾分类处理可以提高回收率和便于处理;B项的新技术可提高采煤时的安全系数,并能充分利用能源;C项中用液化石油气替代后可提高燃料的利用率,并减少氮氧化物的污染。而D中不管烟囱多高,其气体仍排入空气中,不会减少污染,不正确。
4.[答案]A
[分析预测及备考建议]化学反应中的能量变化一直是高考的必考考点,主要有对反应吸热、放热的判断、热化学方程式的书写、简单计算等。在实验中一般是以中和热、燃烧热等测定为载体进行实验操作和数据处理的考查。
[答题技巧]化学反应中一定伴随有能量的变化,且常表现为热量的变化,A选项正确。当反应中反应物的总能量高于生成物的总能量时,根据能量守恒可知,必须有部分能量发生转化而以热量的形式放出,B项不正确;C项中的Ba(OH)2·8H2O与NH4Cl 的反应是典型的吸热反应;而所有的燃烧反应都是放热反应。
3.[答案] C
[分析预测及备考建议] 了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热、中和热及新能源的开发等概念,是新考纲增设的内容。
[答题技巧] ①在化学反应前后总能量是不变的,即根据能量守恒定律加以探析。②根据热化学反应式,从而准确判断出答案。
2.[答案]D
[分析预测及备考建议] 有机物官能团和基本概念是高考中的必考考点。复习中一定要对概念能做到逐字逐句,理解到位。对有机物的各种官能团所具有的性质特点要了然于心,这样能不变应万变。
[答题技巧] “苏丹红1号”不可能属于甲苯的同系物,因为它的结构中含有N元素; CH2=CH-CO-NH2(丙烯酰胺),能在一定条件下生成高分子化合物,但不是发生缩聚反应,而是发生加聚反应;苯甲酸钠,应是苯的同系物甲苯的氧化产物苯甲酸所对应的钠盐;NaNO2中N元素呈+3价,可以被氧化,所以是起还原剂抗氧化而达到保鲜的目的。
1.[答案] B
[分析预测及备考建议] 本题知识点来源于课本,起点低,要求学生了解识记高科技的发展情况,以培养学生爱国主义的热情。该操作过程是物理变化过程。
[答题技巧] 准确辨别物理、化学变化等概念。
18.已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入1mol N2、3mol H2,初始时两容器的温度体积相同。一段时间后反应达到平衡,为使两容器中的N2在平衡混合物的物质的量分数相同,下列措施中可行的是
A.向甲容器中充入一定量的氦气
B.向乙容器中充入一定量的NH3气体
C.升高乙容器的温度
D.增大甲容器的压强
答案和解析
17.已知t℃下Na2SO3的溶解度是S g。一定质量的Na2SO3溶液加入ag Na2SO3,在t℃恰好饱和。若以Na2SO3·7H2O代替Na2SO3,也使原溶液在t℃恰好饱和,需加入Na2SO3·7H2O(摩尔质量为252g·mol-1)的质量是
A.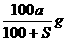 B.
B.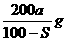 C.
C.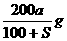 D.
D.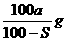
16.电子表所用的某种纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH溶液。电池总反应式为:Zn+Ag2O=ZnO+2Ag, 下列说法错误的是
A.该电池的正极是Zn,负极是Ag2O
B.该电池负极的电极反应式为:Zn+2OH--2e-=ZnO+H2O
C.理论上该电池工作一段时间后,溶液中KOH的浓度不变
D.该电池工作时,电解质中的阴离子向负极移动
15.X、Y为短周期元素,X原子各电子层的电子数比为1:4:1,它比Y原子多3个电子。下列叙述正确的是:
A.X离子半径大于Y离子半径
B.X单质在空气中燃烧可生成两种化合物
C.X、Y形成的化合物与浓硫酸共热可在烧瓶中进行
D.电解X、Y形成的化合物的水溶液可得Y的单质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com