
题目列表(包括答案和解析)
1、在日常生活中,雪碧、可口可乐等饮品都是塑料容器盛装,而盛啤酒的容器却是玻璃制品,很少见到用塑料瓶盛装啤酒,这是由于塑料 ( )
A.造价太高同时形成白色垃圾而引起环境污染 B.太软,饮用和运输时都很不方便
C.相对玻璃透气性强,啤酒易被氧化而变质
D.属有机物,能与啤酒互溶而不与雪碧、可口可乐等饮品互溶
3、“信息”、“材料”和“能源”被称为新科技革命的三大支柱。下列有关资讯错误的是
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率
C.2005年10月12日发射成功的“神舟六号”载人飞船使用了大量的复合材料
D.合成高分子材料的广泛应用是有百利而无一害
2.科学家将液态的金属镓(Ga)充入碳纳米管中,发明出一种世界上最小的温度计--碳纳米管温度计.该温度计通过电子显微镜进行读数,精确度较高,其测量范围在18℃-490℃.下列说法错误的是( )
A.常温常压下镓为液体 B.金属镓的体积在10℃-500℃之间随温度的变化比较均匀
C.碳纳米管的体积在10℃-500℃之间随温度的变化很小,可忽略不计
D.Al(OH)3、Ga(OH)3均是两性氢氧化物
1.一种新型材料B4C,它可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A.B4C是一种分子晶体 B.B4C是一种离子晶体
C.B4C是一种原子晶体 D.该分子是有4个硼原子和1个碳原子构成
18.[答案] A B
[分析预测及备考建议]要求学生在不同情境下,要注意理解等效平衡含义的准确运用。
[答题技巧]在恒温恒压容器或为在恒温恒容容器下,要求达到等效平衡是每年常考试题。甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入1molN 2、3molH2,初始时两容器的温度、体积相同。达到平衡时,甲容器中n(N2)小于乙容器中n(N2),即甲容器中的N 2转化率比乙容器中的N 2大。对于A项,向甲容器中充入一定量的氦气,使甲容器的体积增大,相当于体系压强降低,平衡向生成N2的方向移动,从而N2的含量增大;对于B项,向乙容器中充入一定量的NH3气体,先极端讨论全转化为N 2和H 2,此时,相当于对乙容器加压,平衡向生成NH3的方向移动。从而N 2的含量降低;对于C项,因为正反应是放热反应,升高乙容器的温度,故平衡向生成N2的方向移动,从而N2的含量增大;对于D项,增大甲容器的压强,平衡向生成NH3的方向移动,从而N2的含量降低。
17.[答案]B
[分析预测及备考建议] 掌握溶解度的有关计算问题以及有关概念的辨析等,虽是冰点,也可能会成为热点。往往是学生的弱点,复习中不可不防。
[答题技巧]从题目的叙述中可以理解为加入ag Na2SO3时溶液饱和,改用Na2SO3·7H2O也要达到饱和,换言之,Na2SO3·7H2O中的Na2SO3除了满足原溶液饱和外,还要使结晶水中溶解的Na2SO3也达到饱和,设需Na2SO3·7H2O的质量为x,则Na2SO3·7H2O中含Na2SO3和H2O相等为0.5x,据题意可得:(0.5x-ag):0.5x = S:100,则x=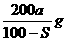 。
。
16.[答案] A
[分析预测及备考建议] 从历年高考试题来看,电化学是必考题型。在不同情境下,其实只要明确电化学的问题都是氧化还原反应原理的延续,那么跨越“e”时代就不会太远了。
[答题技巧] 原电池的负极发生氧化反应,正极发生还原反应,该电池的正极是Zn,负极是Ag2O是错误的。
15.[答案]B
[分析预测及备考建议]元素周期律(表)是中学化学的重要理论知识,对化学的学习和发展都有着不可替代的指导作用。所以也成为考查的重点。重点考查的是根据元素在周期表中的位置判定元素种类和元素间的反应及其产物的特点,同周期、同主族元素金属性和非金属性的递变规律,金属性和非金属性强弱的判断依据等。
[答题技巧]由X原子各电子层的电子数比为1:4:1可知X原子核外有3个电子层,由电子排布规律可知,K层最多不超过2个电子且排满后才能排L层,所以得到X为Mg,从而可知Y是F元素。A比较的是离子半径,对电子层结构相同的粒子核电荷数越大,粒子半径就越小,A不正确;Mg在空气中燃烧时既与O2反应生成MgO,也与N2反应生成Mg3N2,B正确;MgF2与浓H2SO4共热时会生成HF,对玻璃会有强烈的腐蚀作用,所以不能在烧瓶中进行实验,C项不正确;在水溶液中不可能得到F2,因为F2与水剧烈反应生成HF和O2,D也不正确。
14.[答案] B
[分析预测及备考建议]开放实验室,让学生走进实验室,对于中学中的每个实验要弄清楚实验的整个过程、目的,清楚“做什么”、“怎么做”、“为什么要这样做”、“还能想到怎么改进,改进后实验有什么优点并与原实验对比,有什么实际用途,如安全性等”几方面思考。且对常见物质的物理、化学性质准确判断,并会进行相关操作。就不会答非所问,得心应手完成实验的解答。
[答题技巧]①中和热测定中所用的小烧杯必须干燥,不然会吸收热量产生误差④喷泉实验中用于收集NH3的烧瓶必须干燥,若烧瓶内带有水份,会溶解NH3,压强差不够造成喷泉实验失败。②和③中的锥形瓶和容量瓶 带有水份对实验没有影响。
13.[答案]D
[分析预测及备考建议]Na2O、 Na2O2有关的性质,尤其是CO2、H2O与Na2O2的反应的几个重要的关系是高考的热点,如2004年高考中的上海、江苏,2004年全国理综(新、旧)均涉及到。
[答题技巧]本题看似要用到CO、H2与O2反应,CO2、H2O与Na2O2的反应等,实质上题目后面的叙述是干扰,取对水蒸气的相对密度为0.4,则混合气体的相对平均分子量为0.4×18=7.2,运用十字交叉的方法得:
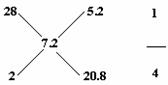
既n(CO):n(H2)=1:4 ,则质量之比为:(1×28):(4×2)=7:2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com