
题目列表(包括答案和解析)
31.(每空2分)(1) 含有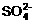 、
、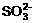 中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自
中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自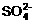 或
或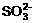 的一种或两种
(2) BaCO 3
(3) 一定有BaSO4,可能有S (4)
的一种或两种
(2) BaCO 3
(3) 一定有BaSO4,可能有S (4) 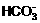 +NH3·H2O+Ba2+
= BaCO3↓+
+NH3·H2O+Ba2+
= BaCO3↓+ +H2O
+H2O
31.(8分)某待测溶液中可能含有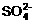 、
、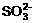 、
、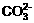 、Cl-、
、Cl-、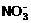 、
、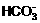 、S2-等离子,进行了下述实验。(所加BaCl2、H2SO4、HNO3、Ca(OH)2均过量)
、S2-等离子,进行了下述实验。(所加BaCl2、H2SO4、HNO3、Ca(OH)2均过量)
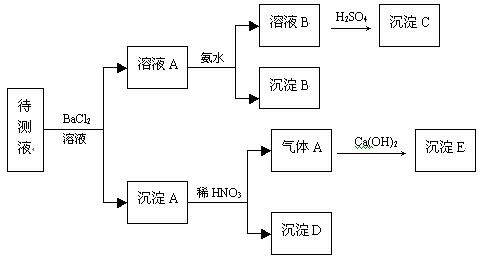
(1) 判断待测液中有无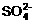 、
、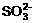 ,并写出理由:____________________________
,并写出理由:____________________________
_____________________________________________;
(2) 写出沉淀B的分子式:____________;
(3) 沉淀C可能是什么物质:____________;
(4) 写出产生沉淀B的离子方程式:_________________________________________。
30.(1) 两支试管中蓝色变浅(1分) (2) 加入锌粉的试管中蓝色褪去的速率快些(1分)
(3) Zn+Cu2+ = Zn2++Cu,使溶液中[Cu2+]减小, 但锌粉与硫酸铜接触面大于锌粒,故反应速率快些(2分)
30.(4分)在两支试管中加入等体积同浓度的硫酸铜溶液, 再分别加入少量等质量的锌粒和锌粉,振荡,观察现象。试回答:
(1) 试管中溶液颜色有何变化?____________________________________________;
(2) 两支试管中的现象有何不同?____________________________________________
_____________________________________________________________。
(3) 用简要文字和有关离子方程式解释上述现象。
_________________________________________________________________________
_______________________________________________________________________。
29. ① H a ② F h ③ C b ④ B f ⑤ E d
29.下表中Ⅰ项为试剂,Ⅱ项为试剂保存方法,Ⅲ项是保存方法的理由, 请分别选出Ⅰ项试剂的保存方法及理由填入“答案”之中。
|
Ⅰ 试 剂 |
Ⅱ 保
存 方
法 |
Ⅲ 保存方法的理由 |
Ⅰ |
Ⅱ |
Ⅲ |
|
① 氢氧化钠溶液 ② 硝酸银溶液 ③ 苯 ④ 氯化镁晶体 ⑤ 钾 |
A. 放入金属容器保存用后密闭保存 C. 密闭保存,置远离火之阴暗处 D. 放入水中保存 E. 放入煤油中保存 F. 放入磨口玻塞棕色瓶中置暗处 G. 不必注意保存 H. 胶塞玻瓶或塑料容器中密闭保存 |
a. 防止与玻璃部分反应而打不开 b. 易汽化,防止火灾 c. 防止见光产生有毒气体 d. 防止与空气中氧气接触而反应 e. 防止其它试剂进入 f. 防潮 g. 防风化 h. 防止见光而使部分试剂还原 |
① |
|
|
|
② |
|
|
|||
|
③ |
|
|
|||
|
④ |
|
|
|||
|
⑤ |
|
|
28. 甲:不严密(1分)。若含乙烯、乙炔等气体也会使溴水褪色,因而不能确定无色气体一定含有SO2 (2分)。 乙:严密(1分)。只有SO2和CO2混合气有此现象(2分)。
28.(6分)两位同学设计了下述两个方案, 并都认为如果观察到的现象和自己所设计的方案一致,即可确定无色气体中一定含有SO2和CO2气体。

方案甲:无色气体─→ ─→ ─→
褪色 不褪色 变浑浊
方案乙:无色气体─→ ─→ ─→
褪色 不褪色 变浑浊
请你评价上述两个方案是否严密,并说明理由。
方案甲:________________________________________________________________;
方案乙:________________________________________________________________。
27.(1) 用玻璃棒搅拌(1分)
(2) 不需要(1分);除去Ca2+、Mg2+后, 在溶液所控制的温度下,可能存在的硫酸盐的溶解度比NaHCO3大 ,且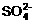 含量少,过滤后会留在母液中(1分)
(3) 使生成NaHCO3的反应充分进行(1分) (4)
含量少,过滤后会留在母液中(1分)
(3) 使生成NaHCO3的反应充分进行(1分) (4)  (1分);取少量待检物放入试管里,滴入少量NaOH溶液,加热(1分),将润湿的红色石蕊试纸放在管口(或蘸有浓盐酸的玻璃棒靠近管口),观察试纸是否变蓝(或是否出现白烟)(1分)
(1分);取少量待检物放入试管里,滴入少量NaOH溶液,加热(1分),将润湿的红色石蕊试纸放在管口(或蘸有浓盐酸的玻璃棒靠近管口),观察试纸是否变蓝(或是否出现白烟)(1分)
27.(8分)实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题:
30℃时几种盐的溶解度/g
|
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
Na2SO4 |
(NH4)2SO4 |
CaCl2 |
MgCl2 |
CaSO4 |
|
36.3 |
27.0 |
11.1 |
41.4 |
40.8 |
78 |
51.7 |
26.2 |
0.165 |
制备纯碱的步骤如下:
① 配制50 mL约25%的粗食盐水溶液(密度近似为1 g/cm3)。
②
精制食盐水(粗食盐中含有少量Ca2+、Mg2+、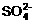 等杂质)用盐酸将滤液的pH值调至7。
等杂质)用盐酸将滤液的pH值调至7。
③ 加热食盐水,将溶液温度控制在30 ─ 35℃。
④ 在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、 搅拌半小时。
⑤ 静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥ 将晶体灼烧,得到纯碱。
(1) 步骤①中,配制溶液的最后一步操作是______________________________;
(2) 步骤②中,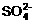 是否需要除去?_________,理由是_____________________
是否需要除去?_________,理由是_____________________
______________________________________________________________________;
(3) 步骤④中所有操作的共同目的是________________________________________;
(4) 步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是____________,在通常情况下,检验这种阳离子的方法____________________________________________________
________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com