
题目列表(包括答案和解析)
2.下列叙述正确的是
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
1.在常温常压下呈气态的化合物,降温使其固化得到的晶体属于
A.分子晶体 B.原子晶体 C.离子晶体 D.何种晶体无法判断
35.(1) (每空1分,共5分) ① NaOH ② NaHCO3 ③ Na2CO3 ④ NaOH、Na2CO3 ⑤Na2CO3、NaHCO3
(2) 由V1>V2>0知混合物中含NaOH和Na2CO3 (1分)
跟NaOH反应消耗HCl的物质的量为(V1-V2)×10-3×0.5 mol (1分)
跟Na2CO3反应消耗的HCl的物质的量为2V2×10-3×0.5 mol
可推知Na2CO3的物质的量为:V2×10-3×0.5 mol (1分)
故原混合物中NaOH% =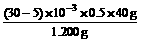 ×100% = 41.67% (1分)
×100% = 41.67% (1分)
Na2CO3% = 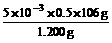 ×100% = 22.08%
(1分)
×100% = 22.08%
(1分)
35.(10分)双指示剂法可用来测定由NaOH、NaHCO3、Na2CO3中的一种或两种物质组成混合物的含量。具体做法是:向待测溶液中加入酚酞,用标准盐酸滴定,当红色褪去,此时NaOH完全被中和,且Na2CO3全部转化为NaHCO3,消耗V1 mL盐酸; 然后再向待测溶液中加入甲基橙溶液,当溶液由黄变橙时,NaHCO3被转化为NaCl,消耗V2 mL盐酸。
(1) 判断物质的组成,请用NaOH、NaHCO3、Na2CO3填写表中的空格:
|
V1、V2的变化 |
①V1≠0, V2=0 |
②V1=0, V2≠0 |
③V1=V2≠0 |
④V1>V2>0 |
⑤V2>V1>0 |
|
试样的成分 |
|
|
|
|
|
(2) 若盐酸浓度为0.5 mol/L,含惰性杂质的混合物的质量为1.200 g, V1为30. 00 mL,V2为5.00 mL,求各物质的质量分数。
34.2NaCl+H2SO4
 Na2SO4+2HCl↑
Na2SO4+2HCl↑
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
NaHCO3+HCl = NaCl+H2O+CO2↑
n (HCl) = n (NaCl) = 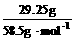 = 0.5
mol,该盐酸溶液为0.5 mol/L。(2分)
= 0.5
mol,该盐酸溶液为0.5 mol/L。(2分)
设Na2CO3和NaHCO3的物质的量分别为x 和y,可得下列二元一次方程组:
 106x + 84y = 1.714
(1分)
106x + 84y = 1.714
(1分)
2x + y = 0.5×0.06 = 0.03 (1分)
x = 0.013 mol (1分)
Na2CO3% = 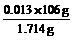 ×100% = 80.4%
(2分)
×100% = 80.4%
(2分)
34.(7分)某化学课外活动小组的同学, 用下述实验方法测定含有碳酸氢钠杂质的纯碱的纯度。取29.25 g氯化钠与过量的浓硫酸作用制取氯化氢气体, 用水全部吸收这些气体制得1000 mL盐酸。取1.714 g含NaHCO3的纯碱样品制成水溶液;将制得的盐酸用滴定管向纯碱样品中逐滴加入,恰至无气体放出时,消耗盐酸60 mL。求这种纯碱样品的纯度是多少?
33.(每空2分) (1) 冷却后的溶液在加入新制Cu(OH)2之前应用NaOH中和剩余的H2SO4,并让NaOH稍过量
(2) 用的是醋酸钠晶体,故几乎生不成甲烷。应用无水醋酸钠与碱石灰共热制甲烷。
33.(4分)简要说明下列实验失败的主要原因:
(1) 做蔗糖水解实验:在试管内加少量蔗糖溶液,再加3─5 mL稀H2SO4,小心煮沸几分钟后,冷却。取少量冷却液加入装有新制Cu(OH)2悬浊液的试管中,加热到沸腾, 无砖红色沉淀产生。原因是____________________________________________________。
(2) 将醋酸钠晶体(CH3COONa·3H2O)与干燥碱石灰按一定质量比混合后加热,为什么会几乎没有甲烷生成?_____________________________________________________。
32.(每空1分) (1) 加热方法好; NH4HCO3可全部分解,无残留物,而加入强碱只除去 ,且消耗试剂; 将湿润的红色石蕊试纸放在试管口,不变蓝色,则分解完全
,且消耗试剂; 将湿润的红色石蕊试纸放在试管口,不变蓝色,则分解完全
(2) 用BaCl2溶液好; 避免溶液中引入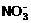 ; 取少量上层清液,滴入BaCl2溶液,如不产生浑浊,表示
; 取少量上层清液,滴入BaCl2溶液,如不产生浑浊,表示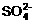 已完全除去
已完全除去
32.(6分)实验室里需要纯净的氯化钠溶液, 但现有的氯化钠晶体中混有少量硫酸钠和碳酸氢铵,设计一组实验除去杂质。试简单回答下列问题:
(1) 除去碳酸氢铵,用加热方法好,还是加入强碱微热方法好__________________,原因是_______________________________________________________,判断碳酸氢铵已完全除去的方法是_________________________________________________________。
(2) 加热的固体残渣溶于水后,应该用氯化钡溶液还是硝酸钡溶液除去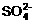 __________
__________
_______________,原因是________________________________________________, 判断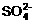 已完全除去的方法是__________________________________________________
已完全除去的方法是__________________________________________________
______________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com