
题目列表(包括答案和解析)
5.设NA为阿伏加德罗常数。下列叙述中正确的是( A )
A.常温常压下,16g臭氧含有氧原子的数目为NA
B.1L1 mol·L-1FeCl3完全水解生成NA个胶体粒子
C.常温下,28g乙烯和一氧化碳的混合物中含有的分子数为2NA
D.1L 1 mol·L-1的盐酸中,所含氯化氢分子数为NA
4.设NA为阿佛加德罗常数,下列说法不正确的是a
A.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B.18g水中含有的电子数为10NA
C.46g 二氧化氮和46g四氧化二氮含有的原子数均为3NA
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
3.下列说法正确的是(NA表示阿伏加德罗常数的值)c
A.28g氮气所含有的原子数目为NA B.4g金属钙变成钙离子时失去的电子数目为0.1NA
C.lmol甲烷的质量与NA个甲烷分子的质量之和相等
D.22.4L甲烷和乙炔混合物所含的分子数为NA
2.设NA表示阿伏加德罗常数,下列说法正确的是 ( B )
A.6.4 g S6与S8的混合物中所含S原子数一定为0.4NA
B.1 mol C10H22分子中共价键总数为31NA
C. 由2H和18O所组成的水11g,其中所含的中子数为4NA
D.在 17g的CH5+中所含的电子数为11NA
1. NA表示阿伏加德罗常数,下列说法正确的是( A )
A.6 g SiO2晶体中含有的硅氧键数目为0.4NA
B.1.0L 0.1mol/L的NaF溶液中,含F-离子数目是0.1NA
C.7gCnH2n中含有的氢原子数目为2NA
D.1mol FeCl3跟沸水完全反应转化为氢氧化铁胶体,其中胶体粒子的数目是NA
27、(1)① 碳(C );铁(Fe) ② 4 OH--4 e-=== 2H2O + O2↑
(2)①2 Cl-+2H2O 2 OH-+H2↑+Cl2↑
2 OH-+H2↑+Cl2↑
②5Cl2 + I2 + 6H2O === 10HCl + 2HIO3
③13

27、甲、乙两池电极材料都是铁棒与碳棒(如下图) 请回答下列问题:
请回答下列问题:
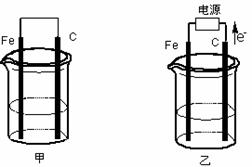
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的 棒;乙池中的 棒。
②在乙池中阳极的电极反应式是 。
(2)若两池中均盛放饱和NaCl溶液
①写出甲池中正极的电极反应式 。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化 若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸
若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸 该反应的化学方程式为 。
该反应的化学方程式为 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则此时溶液的pH= 。(不考虑电解产物的相互反应)
26、某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O
⑴请将Au2O3之外的反应物与生成物分别填如以下空格内

⑵反应中,被还原的元素是 ,还原剂是 。
⑶将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目

⑷纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
26(本题共8分)
⑴Au2O3、Na2S2O3、H2O、Na2S4O6、Au2O、NaOH
⑵Au Na2S2O3
⑶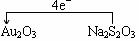 ⑷1:4
⑷1:4
25.(10分)
(1)bc (2)b
(3)消耗的O2物质的量: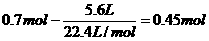
生成的SO3物质的量: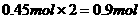
SO2和SO3的物质的量和: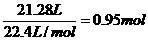
反应前的SO2物质的量: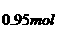
SO2的转化率: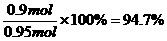
(4)在给定的条件下,溶液呈强酸性,BaSO3不会沉淀 因此BaSO4的质量
因此BaSO4的质量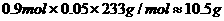
25.(10分)将一定量的SO和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2
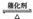 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.生高温度
(3)求该反应达到平衡时SO3的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com