
题目列表(包括答案和解析)
9.下列各离子组在指定条件下一定能共存的是( )
A.常温条件下某无色溶液含有:Ba2+,Fe3+,NO3-,Cl-
B.pH=0的溶液中,Na+,Fe2+,SO42-,CLO-
C.常温下,由水电离出来的C(H+)=10-12mol/L的溶液中:K+,Na+,CLO4-,NO3-
D.使甲基橙溶液变红的溶液中Na+,K+,S2-,I-
8.下列各组物质稀溶液相互反应。无论前者滴入后者,还是后者滴入前者,反应现象相同,且离子方程式也相同的是( )
A.Ba(HCO3)2溶液与Ba(OH)2溶液 B.NaAl02溶液与稀硫酸溶液
C.Ca(HCO3)2溶液与NaON溶液 D.氨水与硝酸银溶液
7.NA表示阿伏加德罗常数的值,下列有关叙述正确的是( )
A.1mol金属镁晶体中含有2NA个自由电子
B.1mol石墨晶体中含有共价键键数为3NA
C.1mol Zn与足量的盐酸反应生成NA个氢分子,体积约为22.4L
D.含CH3COON和CH3COONa的总物质的量为0.1mol的混合溶液中,CH3COOH分子和 CH3COO-离子总个数为0.1NA
6.下列叙述正确的是( )
A.10g质量分数10%的盐酸蒸发掉5g水可得质量分数为20%的盐酸
B.25℃ pH=12的Ba(OH)2溶液和0.001mol/L的硫酸溶液混合,当混合液的pH=11时,V[Ba(0H)2(aq)]:V[H2S04(aq)]=3:9
C.0.1mol/L的CH3COONa溶液中C(H+)=COH-)+C(CH3COOH)
D.常温下,0.2mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合,混合液pH一定小于7。
5. A元素原子最外层电子数为a,次外层电子数为b;B元素的原子M层电子数为a-b,L层电子数为a+b;则对AB两元素形成的化合物晶体叙述正确的是( )
A元素原子最外层电子数为a,次外层电子数为b;B元素的原子M层电子数为a-b,L层电子数为a+b;则对AB两元素形成的化合物晶体叙述正确的是( )
A.分子晶体,是一种弱电解质 B.离子晶体,是一种强电解质
C.是一种合金 D.原子晶体,是一种非电解质
高三化学(模拟一)第1页(共6页)
4.某金属氧化物在光照下可生成具有很强氧化能力的物质,能用来消除空气和水体中的污染物,下列有关该金属氧化物的应用叙述不正确的是( )
A.将形成酸雨的SO2氧化成SO3
B.将装修家居释放出来的甲醛氧化成CO2和水
C.将医药废水中的苯酚氧化成C O2及水
D.将电镀废水中的氰根(CN一)氧化成C O2及N2
3.已知25℃、101kpa条件下:
(1)4AI(s)+302(g)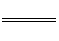
 2A1203(s);△H=-2834.9kJ·mol-1
2A1203(s);△H=-2834.9kJ·mol-1
(2)4A1(s)+203(g)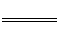
 2Al2O3(s);△H =-3119.1KJ·mol-1
2Al2O3(s);△H =-3119.1KJ·mol-1
由此得出的结论正确的是( )
A.3mol氧气生成2mol臭氧放出的热量284.2kJ
B.等质量的O2比O3的能量高
C.O3比O2稳定,由O2变为O3的化学反应为放热反应
D.O2比O3稳定,由O2变为O3的化学反应为吸热反应
2.下列叙述正确的是( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.元素由化合态变成游离态时,它可能被氧化,也可能被还原
C.失电子难的原子,获得电子的能力一定强
D.有单质参加或生成的反应一定属于氧化还原反应
1.2008年诺贝尔化学奖获得者之一钱永健在发现研究绿色莹光蛋白(GFP)如何发光等作出了突出贡献。下列对GFP等的叙述合理的是( )
A.GFP在硫酸铜或饱和硫酸铵溶液中发生盐析,盐析是可逆过程
B.GFP在酸、碱、酶作用下发生水解,水解的最终产物氨基酸只能与碱反应
C.GFP在乙醇等作用下会凝结、变性,变性为不可逆过程
D.GFP与水的液态混合物可用盐析法分离,盐析法为化学方法
8、北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)===CH4(g)+HC≡CH(g)+H2(g);△H1=156.6 kJ·mol-1
CH3CH=CH2(g)===CH4(g)+HC=CH(g);△H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)===CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为___________;放电时,CO32-移向电池的_______(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(4)常温下,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是_______________________(用离子方程式和必要的文字说明)。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com