
题目列表(包括答案和解析)
27、有一白色固体混合物,可能含有有的阴、阳离子分别是
|
阳离子 |
K+ Ba2+ Ag+ Mg2+ NH4+ Na+ |
|
阴离子 |
SO42- SO32- CO32- AlO2- |
为了鉴定其中的离子,现进行如下实验,根据实验现象,填写下列表格:
(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。
|
排除的离子 |
排除的依据 |
|
|
|
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。
|
肯定存在的离子 |
判断依据 |
|
|
|
|
排除的离子 |
排除的依据 |
|
|
|
(3)尚待检验的离子及其检验方法
|
尚待检验的离子 |
检验方法 |
|
|
|
26、 (1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+
Cu2++Fe=Cu+Fe2+ 2Au3++3Fe=2Au+3Fe2+
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
26、某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
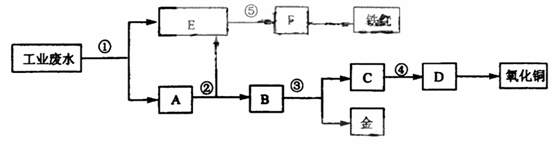
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
25、金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN -和金属离子的配离子M(CN)nm-的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
 Ag++2CN -
== [Ag(CN)2] -
Ag++2CN -
== [Ag(CN)2] -
终点时,溶液由黄色变成橙红色。
根据以上知识回答下列问题:
⑴水样预处理的目的是 。
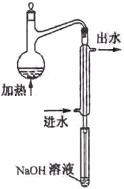
⑵水样预处理的装置如右图,细导管插入吸收液中是为了
。
⑶蒸馏瓶比吸收液面要高出很多,其目的是 。
⑷如果用盐酸代替磷酸进行预处理,实验结果将 (填“偏高”、“无影响”或“偏低”)。
⑸准确移取某工厂污水100mL,经处理后用浓度为0.01000mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00mL。此水样中含氰化合物的含量为 mg·L-1的(以计,计算结果保留一位小数)。
25 ⑴将含氰化合物全部转化为CN - ⑵完全吸收HCN,防止气体放空
⑶防止倒吸 ⑷偏高 ⑸109.2
24.⑴K= 放热 ⑵b 1.5×10-3mol·L-1·s-1 ⑶b c ⑷c
24.在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
⑴写出该反应的平衡常数表达式:K= 。
 已知:
已知: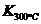 >
>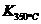 ,则改反应是 热反应。
,则改反应是 热反应。
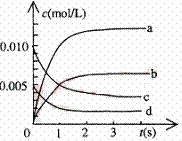
⑵右图中表示NO2的变化的曲线是 。
用O2表示从0~2s内该反应的平均速率v= 。
⑶能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变
⑷ 为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
23、(1)放热
(2)减小;该反应正反应为放热反应,升高温度使平衡向逆反应方向移动;
(3)不影响;催化剂不改变平衡的移动。 (4)减小、减小
23.(8分)反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
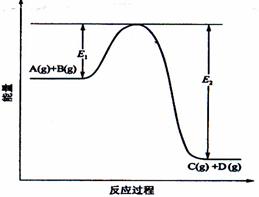
(1)该反应是____________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),
原因是____________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________:
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
22. (1)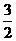 Cl2(g)+
P(s)= PCl3(g)
△H =-306kJ/mol
(3分)
Cl2(g)+
P(s)= PCl3(g)
△H =-306kJ/mol
(3分)
(2)PCl5(g)= PCl3(g)+ Cl2(g) △H =93kJ/mol (3分)
25% 大于 (2分)
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解 (3分)
(4)-399kJ/mol 等于 (2分)
(5)PCl3+4H2O=H3PO4+5HCl (2分)
22.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
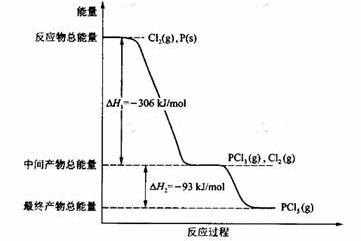
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率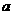 1等于
;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于
;若反应温度由T1升高到T2,平衡时PCl5的分解率为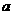 2,
2,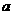 2
2
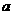 1(填“大于”、“小于”或“等于”);
1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是
;
(4)P和Cl2分两步反应生成1 mol PCl5的△H 3= ,P和Cl2一步反应生成1 mol PCl5的△H 4 △H 3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com