
题目列表(包括答案和解析)
17.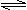 某二元酸(H2A)按下式发生电离:H2A = H++HA-;HA- H++A2-。关于下列四种溶液的说法正确的是
某二元酸(H2A)按下式发生电离:H2A = H++HA-;HA- H++A2-。关于下列四种溶液的说法正确的是
①0.01mol/L的H2A溶液 ②0.01mol/L的NaHA溶液
③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合
④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
A.四种溶液中c(HA-)浓度大小:③>①>②>④
B.溶液①中粒子浓度大小顺序是:c(H2A)>c(H+)>c(HA-)>c(A2-)>c(OH-)
C.溶液②中有关离子浓度关系:c(HA-)+2c(A2-)+c(H2A)=c(Na+)
D.溶液③中有关离子浓度关系:c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+)
16.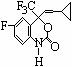 M是一种冶疗艾滋病的新药(结构简式见右图),已知M分子中-NH-COO-基团(除H外)与苯环在同一平面内,关于M的以下说法正确的是
M是一种冶疗艾滋病的新药(结构简式见右图),已知M分子中-NH-COO-基团(除H外)与苯环在同一平面内,关于M的以下说法正确的是
A.该物质易溶于水
B.M能发生加聚反应
C.M的分子式为C13H12O2NF4
D.M分子内至少有13个碳原子在同一平面内
15.下列离子方程式正确的是
A.碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3·H2O
B.Fe(OH)3与氢碘酸溶液混合:Fe(OH)3+3H+=Fe3++3H2O
C.电解精炼铜的阴极反应是:Cu2++2e-=Cu
D.1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
2AlO2-+5H+ = Al(OH)3↓+Al3++H2O
14.如图为一种钮扣微型电池,其电极分别为Ag2O和Zn,电解质溶液是KOH溶液,俗称银锌电池,该电池的总反应式为:Zn +Ag2O== ZnO+2Ag
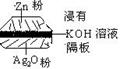 根据以上提供的资料,判断下列说法正确的是
根据以上提供的资料,判断下列说法正确的是
A.锌为负极,Ag2O为正极
B.放电时正极附近溶液的pH升高
C.放电时负极附近溶液的pH升高
D.溶液中阴离子向正极方向移动,阳离子向负极方向移动
13.在pH为4-5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法正确的是
A.加入纯Cu将Fe2+还原
B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4-5
12.利用右图进行实验,下列实验结果能说明结论的是
A.甲:盐酸,乙:石灰石,丙:苯酚钠溶液。
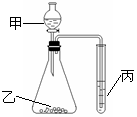 证明酸性:盐酸>H2CO3>C6H5OH
证明酸性:盐酸>H2CO3>C6H5OH
B.甲:盐酸,乙:硫化亚铁,丙:溴水。
证明还原性:S2->Br->Cl-
C.甲:水,乙:电石,丙:溴水。
证明稳定性:H2O>C2H2>Br2
D.甲:浓盐酸,乙:高锰酸钾,丙:溴化钾溶液。
证明氧化性:KMnO4>Cl2>Br2
11.下列各组离子,在指定的环境中一定能大量共存的是
A.在pH为7的溶液中:Ag+、K+、SO42-、Cl-
B.在能使pH试纸变深蓝色的溶液中:Na+、S2-、NO3-、CO32-
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-、
D.在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
10.能说明碳元素的非金属性比硅元素强的是
A.甲烷比硅化氢稳定 B.碳与SiO2反应生成硅
C.碳酸与硅酸钠溶液反应生成原硅酸 D.高温下SiO2和Na2CO3反应
9.NA代表阿伏加德罗常数的值,下列说法正确的是
A.1 mol HNO3见光分解,转移电子数4NA
B.28 g晶体硅中含有Si-Si键的数目为2NA
C.100 mL 0.5 mol/L的(NH4)2SO4溶液中,含有0.1NA个NH4+
D.Cu与浓硝酸产生的22.4 L(标准状况)气体中含原子数为3NA
8.恒温、恒压下,a molA和b molB在一个容积可变的容器中发生如下反应:
A(g)+2B(g) 2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
A.物质A、B的转化率之比为a∶b
B.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b-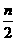 )
)
C.若起始时放入2a molA和2b molB,则达平衡时生成2n molC
D.当v正(A)=2v逆(B)时,可确定反应达平衡
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com