
题目列表(包括答案和解析)
4. 在反应:2A+B 3C+4D中,所表示的反应速率最快的是 ( )
在反应:2A+B 3C+4D中,所表示的反应速率最快的是 ( )
A.v(A)=0.4 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=1.2 mol·L-1·s-1 D.v(D)=0.8 mol·L-1·s-1
3.有关化学基本概念的判断依据正确的是 ( )
A.公家化合物:是否含有共价键
B.氧化还原反应:元素化合价是否变化
C.强弱电解质:溶液的导电能力大小
D.金属晶体:晶体是否能够导电
2.2008年北京奥运会“祥云”火炬采用的是环保型燃料--丙烷(C3H8),已知丙烷的燃烧热为2221.5kJ·mol-1,下列热化学方程式正确的是 ( )
A.C3H8(g)+5O2(g)===3CO2(g)+4H2O(g);△H=-2221.5kJ·mol-1
B.2C3H8(g)+10O2(g)===6CO2(g)+8H2O(l);△H=-2221.5kJ·mol-1
C.C3H8(g)+5O2(g)===3CO2(g)+4H2O(g);△H=+2221.5kJ·mol-1
D.C3H8(g)+5O2(g)===3CO2(g)+4H2O(l);△H=-2221.5kJ·mol-1
将正确选项的序号填在题干的括号内)
1.意大利科学家获得了极具有理论研究意义的N4分子,N4分子结构如图所示。下列说法正确的是 ( )
A.N4属于一种新型的化合物
B.N4晶体属于原子晶体
C.每个N都满足8电子稳定结构
D.N4和N2互为同位素
|
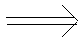 |
|
V V V
然后把两个容器中的物质压缩到一个容器中去,而对于2SO2+O2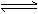 2SO3(g) ,压缩,平衡右移,故SO2的转化率增大。正确答案为B.
2SO3(g) ,压缩,平衡右移,故SO2的转化率增大。正确答案为B.  练习2:在一定温度下,向一个容积固定的密闭真空容器中充入2molX气体,发生反应X(g)
练习2:在一定温度下,向一个容积固定的密闭真空容器中充入2molX气体,发生反应X(g)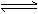 Y(g)+Z(g),使反应达到平衡,这时容器中的混合气体中X气体的体积分数是a%. 若在同一容器中,最初放入的是1 molY 和1 molZ 的混合气体,并在相同的温度下使反应达到平衡,这时混合气体中 X 气体所占的体积分数是b% 。则 a 和b 的关系是(
)
(A)
a>b (B)
a=b (C)
a<b (D) 2a=b
(参考答案为A. )
Y(g)+Z(g),使反应达到平衡,这时容器中的混合气体中X气体的体积分数是a%. 若在同一容器中,最初放入的是1 molY 和1 molZ 的混合气体,并在相同的温度下使反应达到平衡,这时混合气体中 X 气体所占的体积分数是b% 。则 a 和b 的关系是(
)
(A)
a>b (B)
a=b (C)
a<b (D) 2a=b
(参考答案为A. )
3.调整心态、适度模拟
任何成功都需要一定的条件,高考也不例外,许多人认为成绩好(智力好)就行,其实不然,我们周围平时有许多成绩好的同学考不过平时成绩平平的同学的例子,究其原因,心理状态起到了决定性的作用。考试焦虑是每一位同学都要遇到的问题,由准备考试所引起的一定程度上的心理紧迫感,是正常的心理保护反应,对自己的身体、心理及学习活动,不仅没有害处,反而会有益处:当然,考试焦虑比较严重的,如,一进教室、一听老师讲课、一拿起书就头痛、恶心的同学应离开学习场所休息一段时间,或者针对自己的一些心理症状,向心理老师咨询。我想,适度的心理定位和充分的自信,加上有规律的学习活动和体育运动,就能调整好自己的心理状态。在临近高考时,适度的模拟训练,也可以帮助自己尽早进入角色,在高考中取得好成绩。
根据个人水平,有选择地适度做一些新题或研究分析一些新题解法,目的在于体会集训试题的新视角、新思路、新方法以及体现命题改革的新观念,切不宜多。一些联系环境、健康、能源、化学新成就、识别伪科学等体现化学价值的应用题,重视化学科学思想方法、化学实验方法的考查题,可以拓宽解题思路。如分析目前抗非消毒剂过氧乙酸的性质、作用及保存、二氧化氯(ClO2)的消毒作用等题,从氧化还原反应的角度进行分析,提高应用能力。

附一
化学平衡中常用的几种解题思想
“化学平衡”章节是纯理论部分,在中学化学中占有很重要的地位。但该部分内容抽象,很多同学学起来感觉很困难,特别是对该部分的练习,更是无从下手。即使背熟了相关原理,解题还是觉得很棘手。
现介绍几种基本解题思想,供同学们参考。
一、等价转化
等价转化是一种数学思想,借用到化学平衡中,可以简化分析过程。它指的是:化学 平衡状态的建立与反应途径无关,即不论可逆反应是从正方向开始,还是从逆方向开始,抑或从中间状态开始,只要起始所投入的物质的物质的量相当,则可达到等效平衡状态。
这里所说的"相当"即是"等价转化"的意思。
例1、在一个容积固定的密闭容器中,加入m molA, n molB, 发生反应mA(g)+nB(g)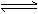 pC(g), 平衡时C的浓度为w mol/L,若容器体积和温度不变,起始时放入a molA, b molB, c
molC, 要使平衡后C的浓度仍为w mol/L, 则a、b 、c必须满足的关系是(
)
A a:b:c=m:n:p
B a:b=m:n , (ap/m)+c=p
pC(g), 平衡时C的浓度为w mol/L,若容器体积和温度不变,起始时放入a molA, b molB, c
molC, 要使平衡后C的浓度仍为w mol/L, 则a、b 、c必须满足的关系是(
)
A a:b:c=m:n:p
B a:b=m:n , (ap/m)+c=p
C
(mc/p)+a=m,(nc/p)+b=n
D a=m/3, b=n/3, c=2p/3
分析:mA(g) + nB(g)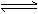 pC(g),
Ⅰ m mol n mol 0
Ⅱ a mol b mol cmol
根据等价转化思想:达到相同的平衡状态,则必须起始投料"相当",第Ⅱ次投入c molC,等价于投入 nc/p molB,mc/p molA. 故必须满足:mc/p +a=m,nc/p
+b=n。再把上式进行变形,即可得到B 项。故正确答案为B,C.
练习1:在密闭容器中发生反应2SO2+O2
pC(g),
Ⅰ m mol n mol 0
Ⅱ a mol b mol cmol
根据等价转化思想:达到相同的平衡状态,则必须起始投料"相当",第Ⅱ次投入c molC,等价于投入 nc/p molB,mc/p molA. 故必须满足:mc/p +a=m,nc/p
+b=n。再把上式进行变形,即可得到B 项。故正确答案为B,C.
练习1:在密闭容器中发生反应2SO2+O2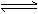 2SO3(g), 起始时SO2和O2分别为20mol 和 10mol , 达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为(
)
A 10mol 10% B 20mol
20% C 20mol
40% D 30mol 80%
(参考答案为 B )
2SO3(g), 起始时SO2和O2分别为20mol 和 10mol , 达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为(
)
A 10mol 10% B 20mol
20% C 20mol
40% D 30mol 80%
(参考答案为 B )
2.针对历届高考易失分点,查漏补缺
尽管每年的考生个体有差异,但是,如果将历届高考题得分率低的试题加以比较,就会发现,有许多易错点是历届学生共同犯的。
(1)思维的变通性差
许多学生受高考迎考题海的影响,拿到试题后若遇“似曾相识”,必快速下结论,往往也是失分率较高的。比如: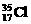 和
和 若知平均相对原子质量,求二者个数比或某一种的丰度,学生很熟,若改问求
若知平均相对原子质量,求二者个数比或某一种的丰度,学生很熟,若改问求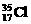 占的质量分数?许多学生仍用原来的思维习惯求解,大错特错。所以在做习题时,同学们试着举一反三,改头换面,增强自己思维的变通性和灵活性。
占的质量分数?许多学生仍用原来的思维习惯求解,大错特错。所以在做习题时,同学们试着举一反三,改头换面,增强自己思维的变通性和灵活性。
(2)语言表达能力差
尽管《考试说明)对简答题没有明确的要求,但不代表高考不考查学生的语言表达能力,而这种能力是历届高考化学科中最薄弱的。出现的问题有:答不到要点上,讲了很多话,有用的字没几个;答不出关键的词语;语句不通顺;不讲究简答的方式,理科的学生有时结合数理逻辑答简答题更好;不是简答而是繁答,叙述太多等。
(3)规范化做题急待加强
一份150分的试卷,平时成绩差不多的同学考分若相差3-5分,不是智力因素的差异,而是答题习惯等非智力因素导致的:列几个方面望同学们避免:化学用语中出现错别字要扣分的,如“加成反应”写成“加层反应”,“苯”写成“笨”,“烯烃”写成“稀烃”;化学方程式不配平、漏写反应条件、“↑、↓”号不写、化学式写错均要扣分;化学用语书写错误也是造成无谓失分的重要原因。如写元素名称,有同学粗心写成符号,写离子方程式,则写成化学方程式,写结构简式,则写成化学式等。答计算题时,自作聪明,不要步骤,一步写出结果,如果结果对,算你走运,但也要扣分,若不对,就要全扣;有机物中原子之间的连接顺序经常被扣分,如

(4)新信息题失分较多
为了加强高考的选拔功能,试题中有一定量的新信息题,信息给出的方式有:文字表达、图、表、框图、数字等,许多学生对这种新情境的试题心有余悸,故历年高考新信息题得分率均不很高,希望引起同学们的重视,加强训练,寻找解题的方法。
(5)化学实验能力差
高考卷2道实验题第1道为小实验题,也是基础题,第2道为大实验题,是拉分题。第2道大实验题应关注气体性质与物质制备结合的;新信息与基本操作融合的;实验原理灵活运用的;综合实验(定性与定量)的;实验方案设计的、评价的、选择的。
1.解剖高考试卷的结构,进行专题强化
根据《考试说明》,化学样卷为26道题,其中选择题18道,非选择题8道;第Ⅱ卷的8道题分布分别是2道化学实验.2道无机与理论,2道有机化学,2道化学计算。分析近几年的高考化学试卷,尽管不能说猜中试题.但一些规律性的东西是可以总结出来的,故在复习的后期,对学生不是去炒已复习过的“凉饭”,而可以采用小专题,有针对性地训练学生的综合解题能力、巩固重要知识点、提高应试素质。同学们可根据自己的复习情况,自主地归纳整理一些小专题,如从高考热点上:与NA有关的计算类小问题;离子共存;离子方程式正误的判断;不用试剂或用-种试剂鉴别多种物质;溶液中离子浓度大小排队;热化学方程式及反应热计算;氧化还原反应方程式配平;混合液pH计算;晶体结构和化学键:反应速率及勒沙特列原理的应用;有机新信息题;化学实验方案的设计及实验方案的选择、评价等。从教材的重点、难点上:元素化合物是学生容易掌握的,学生的抽象思维能力和理解能力差,导致基本概念和基本理论掌握不牢,而这一薄弱环节在150分中占35%,必须引起同学们的重视。基本概念和理论主要存在以下几个专题:阿伏加德罗定律及推论;金属性、非金属性强弱判断原理及应用:同周期、同主族元素性质的递变;化学键理论;四种晶体的有关知识;勒沙特列原理;弱电解质的电离平衡及电离理论;溶液中微粒间的关系(物料守恒和电荷守恒):中和滴定原理;三池的原理;胶体的知识。从学生的知识、能力薄弱环节上:简答题的解法研究;选择题的巧解与速解;与成环有关的有机合成题;与数学知识有关的讨论型计算题等。
例1.甲酸(HCOOH)、乙酸(CH3COOH)、乙二酸(HOOC-COOH)均为有机羧酸。
(1)若甲酸、乙酸、乙二酸等物质的量混合的混合酸a mol,完全燃烧消耗的氧气的物质的量为_____mol。(用a的关系式表示)。
(2)若甲酸和乙二酸以任意比例混合所得的混合酸b mol,消耗氧气的物质的量为______mol。(用含b关系式表示)。
(3)有甲酸、乙酸和乙二酸的混合酸(任意比)m g,完全燃烧后恢复到标态下得到2.24L CO2气体。如果完全中和上述m g混合酸,需要1 mol·L-1的NaOH溶液80 mL。则m的取值范围是______。
分析:第(1)问不难求解,答案为amol。第(2)甲酸与乙二酸与氧气反应均为1:2,所以,答案为0.5b。(3)设甲酸(C2H2O2)为xmol,乙酸(C2H4O2)为ymol,乙二酸(C2H2O4)zmol,根据碳原子守恒,x+2y+2z=0.1,根据与氢氧化钠反应得出定量关系式x+y+2z=0.08,两式相减得y=0.02mol, x+2z=0.06mol, 当x=0时,z=0.03,m为最小值0.03×90+60×0.02=3.9,当z=0,x=0.06时,m为最大值60×0.02+0.06×46=3.96g,所以答案为3.9<m<3.96。
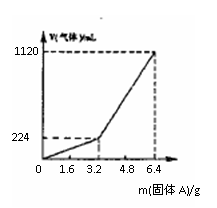 例2.将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300 mL 2 mol·L-1盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。
例2.将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300 mL 2 mol·L-1盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。
已知加入固体A的质量m≤3.2g时,收集到的气体为氢气;当m>3.2g时,收集到的气体为H2和H2S的混合气。
试分析与计算:
(1)3.2g固体A中所含的物质有______;
(2)3.2g固体A中各物质的物质的量分别为__________,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为(忽略溶液体积的变化)______________;
(3)当固体A全部溶于上述盐酸,且A的质量m>3.2g时,收集到的气体体积(标准状况下)V=_________mL(用含m的代数式表示)。
分析:(1)由m>3.2g时,收集到的气体为H2和H2S的混合气,可得到原固体中含的物质的是Fe和FeS(Fe+2HCl=FeCl2+H2↑, FeS+2HCl=FeCl2+H2S↑)
而m≤3.2g时,收集到的气体为氢气,H2S哪去?
(2)由题意氢硫酸溶液饱和前无硫化氢气体逸出,可知产生的H2S溶解在溶液中,当m=3.2g时,H2S恰好饱和。
3.2g中:Fe~H2
1mol 22.4L
n(Fe) 0.224L
n(Fe) = 0.01mol
当m由3.2g变化到6.4g,参加反应的固体亦为3.2g,既有H2S和H2,共1120mL-224mL=896mL,即0.04mol
其中H2为224mL即0.01mol,
所以 n(H2S)=0.04mol-0.01mol=0.03mol
所以 n(FeS)=0.03mol
即3.2g固体可产生H2S 0.03mol
C(H2S)=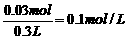
(3)由上可知,3.2g产生H2S和H2共896mL
所以,mg固体可产生H2S和H2 m/3.2×896=280m,其中0.03mol即 672mL溶解在溶液中。所以,实际收集到的气体为(280m-672)mL。
答:(1)Fe、FeS (2)n(Fe)=0.01 mol、n(FeS)=0.03 mol c(H2S)=0.1 mol·L-1
(3)280m-672
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com