
题目列表(包括答案和解析)
3.在25℃时,浓度均为1 mol/L 的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2(硫酸亚铁铵)三种溶液中,测得其中c(NH4+)分别为 a mol/L、b mol/L、c mol/L,则下列判断正确的是
A.a>b>c B.a>c>b C.b>a>c D.c>a>b
2. 吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是
A. 还原剂 B. 氧化剂 C. 既是氧化剂又是还原剂 D. 以上均不是
1.2006年3月,温家宝指出“抓好资源节约,建设环境友好型社会”,这是我国社会和经济长期发展的重要保证。你认为下列行为与之相悖的是
A.研制对目标昆虫有毒杀作用的新型、可降解杀虫剂
B.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
C.研制开发以水代替有机溶剂的化工涂料
D.以聚苯乙烯全面代替木材,生产包装盒、快餐盒等以减少木材使用,保护森林
24.(7分)下表的实线表示元素周期表的部分边界,①-⑥分别表示元素周期表中对应位置的元素。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
① |
② |
③ |
④ |
|
|
⑤ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在上表中用实线补全元素周期表边界
(2)元素②的氢化物电子式为: 。
(3)元素④的氢化物在CCl4中溶解度比在水中的溶解度 (填“大”或“小”)。
(4)元素⑤的单质,元素⑥的单质和⑤⑥形成的合金,这三种物质中,熔点最低的是 。
A.元素⑤的单质 B.元素⑥的单质
C.⑤⑥形成的合金 D.无法判断
(5)由元素①的最简单的氢化物,元素③的单质和KOH溶液组成的新型燃料电池中,负极上发生的反应的电极反应式为: 。
21.(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA的浓度/(mol·L-1) |
NaOH的浓度/(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c |
0.2 |
pH=7 |
|
丙 |
0.1 |
0.1 |
pH>1 |
请回答:
(1)不考虑其他组的实验结果,仅从甲组情况分析,如何用a的大小来说明HA是强酸还是弱酸 。
(2)不考虑其他组的实验结果,仅从乙组情况分析,c是否一定等于0.2 (填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是 (填序号)。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
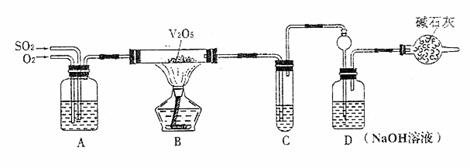 22.(8分)某校活动小组用下图所示装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知C中的浓硫酸含溶质m mol,假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2。
22.(8分)某校活动小组用下图所示装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知C中的浓硫酸含溶质m mol,假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2。
请回答下列问题:
(1)已知0.5 molSO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为
。
(2)实验时A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是
;装置C中浓硫酸的作用为 。
(3)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
(4)实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为ωg。若装置D增加的质量为a g,则此条件下二氧化硫的转化率是 (用含字母的代数表示,结果可不化简)。
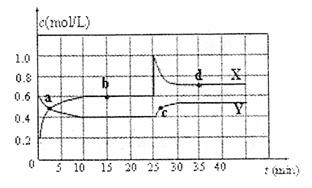
 23.(8分)可知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);△H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如右图。回答
23.(8分)可知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);△H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如右图。回答
下列问题:
(1)图象中的平衡点是: (用a、b、c、d填空)。
(2)图中的两条曲线, 是表示N2O4浓度随时间的变化曲线(填“X”或“Y”)。
(3)前10 min内用υ(NO2)表示的化学反速率为 。
(4)25 min时,导致平衡移动的原因是 。
19.(6分)实验室为检测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:
4CuI+Hg Cu2HgI4+2Cu(化合物中Hg为+2价)
(1)上述反应产物Cu2HgI4中,Cu元素是 价。
(2)以上反应中的氧化剂为 ,当有1mol CuI参与反应时,转移电子
mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:

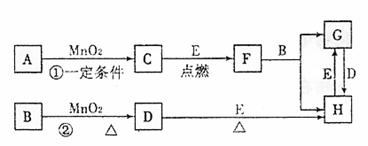 20.(9分)下图所涉及的物质均为中学化学中常见的物质,其中C、D为气体单质,E为常见金属单质,其余为化合物,F晶体具有磁性,它们之间存在如下转化关系(部分产物已省略)。
20.(9分)下图所涉及的物质均为中学化学中常见的物质,其中C、D为气体单质,E为常见金属单质,其余为化合物,F晶体具有磁性,它们之间存在如下转化关系(部分产物已省略)。
请回答下列问题:
(1)若反应①是在加热条件下进行的,则A是(填化学式) ;若反应①是在常温条件下进行的,则A是(填化学式) ;若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为 。
(2)写出②的离子反应方程式: 。
(3)H用途广泛,如用作催化剂,印刷电路腐蚀剂和外伤止血济及净水等。若将Cu棒与碳棒用导线连接并插入H溶液中,可形成原电池,其中正极电极反应方程式为:
。
(4)写出G与D反应生成H的化学方程式为: 。
18.将一定质量的Mg和Al的混合物投入1 mol·L-1500mL稀硫酸中,固体全部溶解并产
生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入
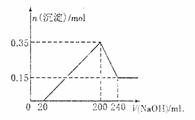 NaOH溶液的体积关系如图所示。则下列说法正确的是 ( )
NaOH溶液的体积关系如图所示。则下列说法正确的是 ( )
A.Mg和Al的物质的量之比1:1
B.NaOH溶液的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2L
D.Mg和Al和硫酸恰好完全反应
第Ⅱ卷(非选择题,共46分)
非选择题(本题包括6小 题,共46分)
17.短周期元素X、Y、Z和W的原子序数依次增大,且均为同周期,四元素原子的最外层
电子数之和为18,X和Y的原子序数比6:7,W原子最外电子层比次外层少一个电子,
下列说法不正确的是 ( )
A.Y的单质为原子晶体
B.X和W可形成离子化合物
C.Z和W的单质发生化学反应可生成两种共价化合物
D.Z和W最高价氧化物对应水化物都是强酸
16.铁和三氧化二铁的混合物共a mol,加入盐酸后固体全部溶解,共收集到b mol氢气,且向溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为 ( )
A.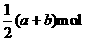 B.
B.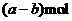
C.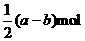 D.b mol
D.b mol
15.右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而使反
应不能进行,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是 ( )
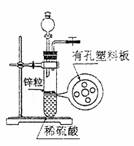 ①
食盐水 ② KNO3溶液
①
食盐水 ② KNO3溶液
③ 适量稀硫酸铜溶液 ④ Na2CO3溶液
⑤ CCl4 ⑥ 浓氨水
A.③⑤ B.②⑥
C.①③⑤ D.①②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com