
题目列表(包括答案和解析)
23.(14分)
(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2 mol·L-1,a = mol·L-1。
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热 (填“大于”、“等于”或“小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则氢气燃烧热的热化学方程式为 。
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应是 。

22.(12分)
居室是我们日常生活中最重要的场所。现代人在“煤烟型”、“光化学烟雾”污染后,正在进入以“室内空气污染”为标志的第三污染时期。造成室内环境污染的有毒物质主要有甲醛、苯、氨、氡四种。
请回答下列问题:
(1)氨分子的电子式是 ,苯分子的空间构型为 。
(2)提出减少室内空气污染的一条措施: 。
(3)我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg•m-3,甲醛测定的方法主要有分光光度法、色谱法、电化学法、化学滴定法等。某校研究性学习小组的同学拟采用化学滴定法对教室内空气中甲醛的含量进行测定,如果你参与该研究课题,你采集甲醛样品的方法是 。
(4)碘量法是化学滴定法之一。碘量法原理为在碱性介质(NaOH)中,碘转化为次碘酸钠和碘化钠,次碘酸钠将溶液中游离的甲醛氧化为甲酸钠;经适当酸化后,剩余的次碘酸钠与碘化钠又生成碘;以淀粉为指示剂,用硫代硫酸钠标准溶液滴定。
上述过程中涉及的化学反应的离子方程式依次为: ①I2+2OH-====IO- + I- + H2O 、② 、③ 、④I2+2S2O32-====S4O62-+2I-。
实验过程中需要测定的数据除总碘量外,还有 。
21.(10分)
碱式氯化铜(Cupric Chloride,不溶于水的绿色结晶)是一种农药,分子式:CuCl2·3Cu(OH)2·xH2O(x=1/2,1,2)。为验证其组成并确定X值,某学生设计了以下几步实验:
①取a g的晶体研成粉末。
②晶体在空气中加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。
③另取a g的晶体,溶于足量某溶液中充分溶解得到溶液。
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
(1)以上实验中用到玻璃棒的步骤有 ____ (填序号)。
(2)步骤②中晶体应放在 _(填仪器名称)中灼烧,灼烧后得到的固体应为______ _____(填化学式)。
(3)步骤③所用的溶液可能是 ;
(4)步骤④主要包括:加入足量硝酸银溶液→ → → 晾干→称量;
(5)若组成符合通式,则可以计算x的物理量组合是 ____ (填序号)。
A.a、b B.a、c C.b、c D.a、b、c 缺一不可
20.(11分)
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。请填写以下空白:
[提出问题]Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①: 。
猜想②:溶液呈中性,且不与酸反应。
猜想③:无还原性,不能被氧化剂氧化。
[实验探究]基于上述猜想②、③,设计实验方案。请填写下列表格中的(1)(2)(3)。
|
|
实验操作 |
实验现象或预期实验现象 |
现象解释 (用离子方程式表示) |
|
猜想② |
(1) |
溶液pH=8 |
--- |
|
向pH=2的硫酸中滴加Na2S2O3溶液 |
(2) |
S2O32-+2H+=S↓+SO2↑+H2O |
|
|
猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
(3) |
[实验结论]Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
[问题讨论]
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由 。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是 。
19.(12分)
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:

根据上述图示,完成下列填空:
⑴明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有251.28 g氨)______mL,用规格为______mL量筒量取。
⑵氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。
检验NH4+的方法是____________________________________________________ __。
⑶写出沉淀物中所有物质的化学式_____________________。
⑷滤液I的成分是水和________________。
⑸为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量________溶液,产生白色沉淀。
②____ ___、_______、_______(依次填写实验操作名称)。
③冷却、称重。
⑹若试样为m g,沉淀的物质的量为 n mol,则试样中K2SO4的物质的量为:_ ___ mol(用含m、n的代数式表示)。
18.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量
C.甲中酸过量、乙中铝过量 D.甲中酸过量、乙中碱过量
17.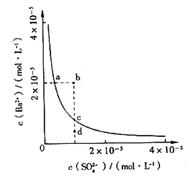 某温度时,BaSO4在水中的沉淀溶解平衡曲线如右图所示。
下列说法正确的是
某温度时,BaSO4在水中的沉淀溶解平衡曲线如右图所示。
下列说法正确的是
A.a点对应的Ksp大于c点对应的Ksp
B.通过蒸发可以使溶液由d点变到c点
C.加入Na2SO4可以使溶液由a点变到b点
D.d点无BaSO4沉淀生成
16.用铁酸钠(Na2FeO4)对来自河湖的淡水消毒是城市饮用水处理新技术,下列对Na2FeO4用于饮用水消毒处理的分析正确的是
A.Na2FeO4在溶液中显强碱性,能消毒杀菌
B.Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
C.Na2FeO4的还原产物Fe3+易水解为Fe(OH)3胶体,可使水中悬浮物凝聚沉降
D.Na2FeO4的还原产物Fe2+易水解为Fe(OH)2胶体,可使水中悬浮物凝聚沉降
15.下表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是
 A.原子半径大小比较为D>A>B>C
A.原子半径大小比较为D>A>B>C
B.A与C形成的阴离子可能有AC32–、A2C42–
C.生成的氢化物分子间均可形成氢键
D.A、B、C、D的单质常温下均不导电
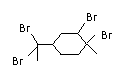
14. 从柑桔中可炼制萜二烯(
),下列有关它的推测不正确的是
从柑桔中可炼制萜二烯(
),下列有关它的推测不正确的是
 A.分子式为C10H18
B. 常温下呈液态难溶于水
A.分子式为C10H18
B. 常温下呈液态难溶于水
C. 能发生加聚反应
D. 与过量溴的CCl4 溶液反应后产物(右图)为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com