
题目列表(包括答案和解析)
23. (7分)一定温度下,将3molA气体和1 molB气体通入一密闭容器中,发生如下
反应: 。请填写下列空白:
。请填写下列空白:
(1)若容器体积固定为2L,反应2min时测得剩余O. 6molB,C的浓度为0. 4 mol/L.则:
① x=______________;
②若反应经4min达到平衡.平衡时C的浓度___________O.8mol/L
(填“大于”、“等于”、或“小于”)
③平衡混合物中,C的体积分数为22%,则B的转化率是______________;
④改变起始物加入的量,欲使反应达到平衡时,C的物质的量分数与原平衡相等,起
始加入的三种物质的物质的量n(A)、n(B)、n(c)之间应该满足的关系式
为_____________________________________________;
(2)若维持容器压强不变,
①达到平衡时C的体积分数____________22%,(填“大于”、“等于”或“小于”)
②改变起始物质加入量,欲使反应达到平衡时,C的物质的量是原平衡的2倍,则A
和B的起始物质的量分别应为__________________________。
21.(12分)
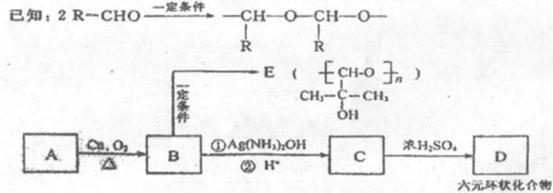
填写下列空白:
(1)由B生成E的反应类型为_____________,B中的官能团名称是_________________
(2) A的结构简式为__________________D的结构简式为_____________________
(3)写出以下转化的化学方程式:
A→B_____________________________________________________________________
B→C[步骤②]_____________________________________________________________
(4)在120℃时,由A,B,E组成的混合物w克与氧气充分反应,消耗氧气[m(0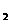 )]的质量范围为____________________________________________
)]的质量范围为____________________________________________
22(7分)两种元素形成的化合物A.它广泛应用于犬规模集成电路生产领域。可按图示进
行反应。已知G、H为单质,C、H为气体,电解熔融的F是工业上制备G的重要方法。
A、B、D、E、F中均含G元素,且G元素在A中占65.9%。反应中部分产物已略去。
(1)F的晶体类型为_______________。
(2)写出反映①的化学方程式:__________________________________________________。
(3)若把B溶液与E溶液混合反应的离子方程式是:________________________________。
(4)用化学方程式表示单质G在工业上的一种应用:________________________________
20.(12分).市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20-50mg/kg |
|
分装日期 |
|
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空
白处):____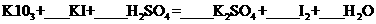
(2)上述反应生成的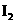 可用四氯化碳检验:确认有
可用四氯化碳检验:确认有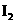 生成的现象是___________________
生成的现象是___________________
利用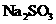 。稀溶液,将
。稀溶液,将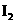 还原,可从碘的四氯化碳溶液中回收四氧化碳。
还原,可从碘的四氯化碳溶液中回收四氧化碳。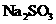 稀溶液与
稀溶液与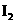 反应的离子方程式为____________________________
反应的离子方程式为____________________________
(3)已知: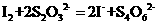 某学生测定食用精制盐的碘含量,其步骤为:
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO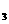 与KI反应完全;
与KI反应完全;
c.以淀粉溶液为指示剂。逐滴加入物质的量浓度为2.0×10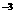 mol/L的
mol/L的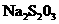 溶液10.OmL,恰好反应完全。
溶液10.OmL,恰好反应完全。
①判断c中恰好完全反应依据的现象是_____________________________________。
②b中反应所产生的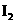 的物质的量是____________mol。
的物质的量是____________mol。
③根据以上实验和包装袋说明测得精制盐的碘(I)含量是(以含w的代数式表示)
___mg/kg。
19.(12分)A、B、C、D、E为原子序数依次增大的五种短周期元素。A、E
同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D最外层电子数
之和与E的核外电子总数相等。试回答:
(1).B在周期表中的位置为___________。化合物BA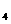 的空间构型为_____________,
的空间构型为_____________,
化台物ABC属于__________分子(填“极性”或“非极性”)。
(2)化合物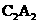 是一种高能量分子,且C原子满足8电子稳定结构。写出
是一种高能量分子,且C原子满足8电子稳定结构。写出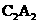 的电子
的电子
式____________。由A、B、C、D四种元素按原子个数比4:l:2:1组成的化合物的名称是_____________。
(3)分子式为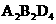 的化合物,与等物质的量的KOH溶液反应后溶液呈酸性,其原因是 (用文字表述)____________________________________________________________
的化合物,与等物质的量的KOH溶液反应后溶液呈酸性,其原因是 (用文字表述)____________________________________________________________
18.(4分).(1)温度计常用来监测或控制化学实验的温度。
请说明下列实验中温度计的水银球所处的位置:实验室
制乙烯____________________,用蒸馏法进行混合物的
分离_______________________________。
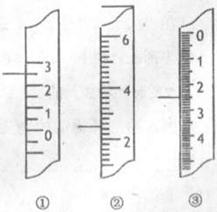
(2)右图分别是温度计、量筒、滴定管的一部分,
下述读数(左侧实线标注位置)及说法正确的是_______ 。
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为3.5 mL
D.①是温度计,读数为2.5℃
 (3)某同学用右图所示装置,将气体发生装置中产生的氯化氢直接通入水中
(3)某同学用右图所示装置,将气体发生装置中产生的氯化氢直接通入水中
配制少量盐酸,结果发生了水的倒吸。在不增加仪器(可选择必需的试剂)
的前提下将右图装置稍加改进,即可安全地在试管中用水吸收氯化氢,改进
的方法是___________________________________
17.(6分)(1)将w克下列某物质在足量的氧气中完全燃烧后,产物全部通入足量的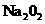 固体粉末中,充分反应后固体增重m克.若w<m则该物质可能是__________(填序号)
固体粉末中,充分反应后固体增重m克.若w<m则该物质可能是__________(填序号)
①氢气 ②甲烷 ③一氧化碳 ④乙二酸 ⑤甲醛 ⑨乙醇
(2)已知,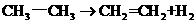 ;有关化学键的键能如下。
;有关化学键的键能如下。
化学键 C-H C=C C-C H-H
键能(kJ/mol) 414.4 615.3 347.4 435.3
写出该反应的热化学反应方程式:_______________________________________。
(3)在沥青中存有稠环芳烃,其中一些可视为荼(A)、芘(B)、蒽并蒽(C),D、E等。
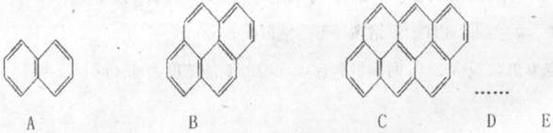
 试推算该系列化合物中,碳的最大质量分数为__________
试推算该系列化合物中,碳的最大质量分数为__________
16.漂白剂亚氯酸钠( )在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:
)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为: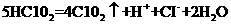 。 (
。 (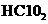 为弱酸)向
为弱酸)向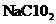 溶液中滴加
溶液中滴加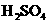 ,开始时
,开始时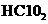 啦分解反应反应缓慢,随后反应迅速,其原因是( )
啦分解反应反应缓慢,随后反应迅速,其原因是( )
A.溶液中的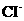 起催化作用 B.溶液中的
起催化作用 B.溶液中的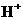 起催化作用
起催化作用
C.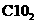 逸出,使反应的生成物浓度降低 D.在酸性条件下,亚氯酸钠的氧化性增强
逸出,使反应的生成物浓度降低 D.在酸性条件下,亚氯酸钠的氧化性增强
2009届江西省重点中学联考盟校第一次模拟考试
化学试卷
第Ⅱ卷(非选择题,共60分)
15.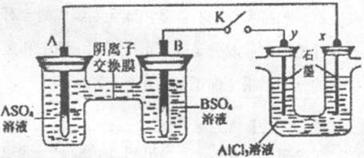 某同学按右图所示的装置进行试验。A、B为两种常见金属,它们的硫酸盐可溶于
某同学按右图所示的装置进行试验。A、B为两种常见金属,它们的硫酸盐可溶于
水。当K闭合时,在交换膜处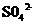 从右向左移动。下列分析正确的是( )
从右向左移动。下列分析正确的是( )
A.溶液中。(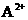 )浓度减小
)浓度减小
B.B的电极反应: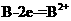
C.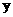 电极上有
电极上有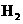 产生,发生还原反应
产生,发生还原反应
D.反应初期, 电极周围出现白色胶
电极周围出现白色胶
14.由环己烷,乙醇,乙醚组成的混合物,测得碳的质量分数为72%,则氧的质量分数( )
A.14.2% B.16% C.17.8% D.无法计算
13.以下是工业上以铬铁矿(主要成分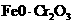 )、碳酸钠、氧气和硫酸为原料生产重铬酸钠(
)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(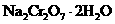 )的主要反应:
)的主要反应:
 ①
①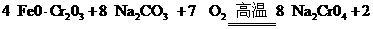 +8
+8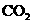
②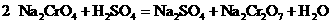
下列说法正确的是( )
A.反应①和②均为氧化还原反应
B.反应①的氧化剂是如,还原剂是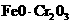
 C. 内物质是
C. 内物质是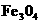
D.生成1 mol的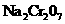 时共转移6 mol电子
时共转移6 mol电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com