
题目列表(包括答案和解析)
7.(11分)以下是25℃时几种难溶电解质的溶解度:
|
难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质。例如:
①为了除去氯化铵中的杂质FeCl3,先将混合物溶于水,再加入一定量的试剂充分反应后,过滤结晶即可;
②为了除去氯化镁晶体中的杂质FeCl3,先将混合物溶于水,加人足量的氢氧化镁,充分反应后,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质FeSO4,先将混合物溶于水,加入一定量的酸性H2O2溶液,将Fe2+化成Fe3+后,调升溶液的pH=4后,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 (填化学式)而除去。
(2)①中加入的试剂应该选择 为宜,其原因是 。
(3)②中除去FeCl3,所发生反应的离子方程式为 。
(4)下列与方案③相关的叙述中,正确的是 (填字母序号)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调升溶液pH=4可选择的试剂是氢氧化铜
D.Cu2+不能大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
2.第Ⅱ卷共4页,用蓝、黑色墨水的钢笔或圆珠笔直接答在试卷上。
相对原子质量:H:1 C:12 N:14 O:16 Na:23
Mg:24 Al:27 S:32 Cl:35.5
第Ⅱ卷(非选择题 共64分)
1.答第Ⅱ卷前,考生务必将密封线内的项目和试卷第3页右上角的“座位号”填写清楚。
6.一定温度下,有可逆反应: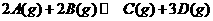 △H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入体积为2V的乙容器。关于两容器中反应的说法正确的是( )。
△H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入体积为2V的乙容器。关于两容器中反应的说法正确的是( )。
A.甲容器中的反应先达到化学平衡状态
B.在甲容器中再充入2molA和2molB,平衡向正反应方向移动,此时平衡常数增大
C.两容器达平衡后升高相同的温度,达到新的平衡,甲、乙容器中平衡混合物中各组分的体积分数不同
D.两容器中的反应均达平衡时,平衡混合物中各组分的体积分数相同,混合气体的平均相对分子质量也相同
|
座位号 (准考证号末两位) |
|
|
|
|
5.下面是常见的电化学装置图,①③④中均为惰性电极,下列说法正确的是( )。
A.装置①中阳极反应式为: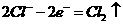 ,阴极反应式为:
,阴极反应式为: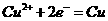 ,电解全后,溶液中的酸性增强
,电解全后,溶液中的酸性增强
B.装置②中铜片为阳极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时铜片和铁制品的质量差为128g
C.装置③中b极为负极,该极的电极反应方程式为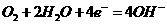
D.装置④中阳离子交换膜上每透过1molNa+时,则阴极上产生11.2L H2
3.下列各组溶液中,不用其它化学试剂,面用物质间两两混合的方法不可能鉴别出的是( )。
A.NaOH、AlCl3、盐酸、Na2CO3 B.BaCl2、AgNO3、Na2CO3、CaCl2
C.淀粉、淀粉和KI、KI、溴水 D.NaHCO3、稀硫酸、Na2SiO3、Na2SO3
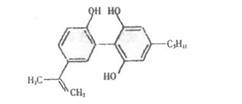 4.我国支持“人文奥运”的一个重要的体现是坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法不正确的是( )。
4.我国支持“人文奥运”的一个重要的体现是坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法不正确的是( )。
A.滴入酸性KMnO4溶液,紫色褪去,可证明结构中存在碳碳双键
B.1mol该物质与H2(一定条件下)反应时,最多消耗H2的物质的量为7mol
C.该分子中所有的碳原子不可能在同一平面上
D,该物质的分子式为C20H24O3,
2.下列说法不正确的是( )。
A.向鸡蛋白溶液中滴入饱和硫酸铵溶液,不会析出白色沉淀
B.向沸水中滴人饱和氧化铁溶液,能制取氢氧化铁胶体
C.浓硝酸溅在皮肤上能使皮肤呈现黄色,是由于浓硝酸和蛋白质发生了颜色反应
D.蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物
1.生活中碰到的某些问题,常涉及到一些化学知识,下列分析不正确的是( )。
A.Mg(OH)2和Al(OH)3均受热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃性气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气 体反应,所以它们可以作为未来发展方向的无机阻燃剂
B.用工业废弃物二氧化碳生产塑料,不会产生白色污染并有助于缓解温室效应
C.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
D.蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质
11.(13分)
工业原料甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g) 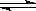 CO2(g)+3H2(g) △H > 0
CO2(g)+3H2(g) △H > 0
(1)一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示的反应速率 。
(2)右图中P是可自由平行滑动的活塞,关闭K,在相同温度下,向A容器中充入1 mol CH3OH和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知,起始时容器A和B的体积均为a L。试回答:
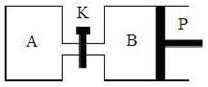
① 反应达到平衡时,容器B的体积为1.5 a L,B容器中CH3OH转化率为 ,A、B两容器中H2O(g)的体积百分含量的大小关系为B A(填“>”、“<”、“=” )
② 若打开K,一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(3)下面四个选项是四位学生在学习化学反应速率与化学反应限度以后,联系化工生产实际所发表的看法,你认为不正确的是_______
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
(4)甲醇等有机物在空气中燃烧时由于燃烧不充分可能会产生CO等污染物。有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:________________。
10.(17分)
Ⅰ.下列有关实验的叙述,正确的是(填序号)
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.酸碱中和滴定时用的滴定管和锥形瓶都要用待装溶液润洗
C.加热烧瓶时,所装液体不超过其容积的3/4
D.用渗析法分离淀粉中混有的NaCl杂质
E.测定中和热实验中,可以用18.4mol/L的硫酸代替0.5mol/L的硫酸
F.在氢氧化铁胶体中加少量硫酸会产生沉淀
G.测某溶液的pH,将pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
H.用浓氨水洗涤做过银镜反应的试管
Ⅱ.某兴趣小组的学生根据Mg与CO2反应原理推测钠也能在CO2中燃烧,为了确定其产物并进行实验论证,某同学设计了下列装置进行实验(已知PdCl2能被CO
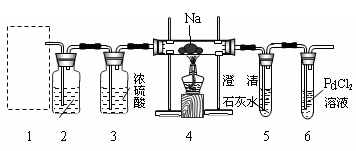 还原得到黑色的Pd)。请回答下列问题:
还原得到黑色的Pd)。请回答下列问题:
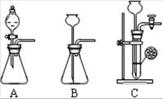
(1)上图装置2中应盛放 溶液(写化学式)。
(2)为了使反应随开随用,随关随停,上图方框内应选用____装置(填上图字母代号)。
(3)检查装置的气密性完好并装好药品后,在点燃酒精灯前,应先进行的操作是__________,待装置5中出现 现象时,再点酒精灯,这步操作的目的是 _______。
(4)①若装置6中有黑色沉淀生成,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为___________________________。
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为 。
(5)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳。当确认钠充分反应后,请你设计一个简单实验,验证装置4中的残留固体中是否有Na2O和C:________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com