
题目列表(包括答案和解析)
17.(广东省梅州市曾宪梓中学2009届高三11月考 )俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为 。下列有关叙述正确的是( D )
。下列有关叙述正确的是( D )
A.X元素的核外电子数为288
B.核素 的质量数与中子数之差为173
的质量数与中子数之差为173
C.113号元素属于非金属元素
D.115号元素的最高正化合价是 +5
[解析]: 的质子数是115、电子数115、中子数173;118-115=3,镅元素位于第七周期,第ⅤA族,113号元素位于第七周期,第ⅢA族,两种元素都是金属。
的质子数是115、电子数115、中子数173;118-115=3,镅元素位于第七周期,第ⅤA族,113号元素位于第七周期,第ⅢA族,两种元素都是金属。
[答案]:D
16、(广东广州花都区2009届高三期初调研试题化学卷) 2H、13C、15N、18O、34S等常用做环境分析指示物,下列对它们的说法正确的是( B)
A.34S原子核内的中子数为16 B.16O与 18O互称同位素
C.13C和15N原子核内的质子数相差2 D.2H的核外电子数比1H多一个
[解析]:因为质量数=质子数+中子数,则AC错;同位素的电子数相等,D错。
[答案]:B
15、[上海09闸北区高三年级化学学科期末练习卷(2009.1)]随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是
A.N5+离子中含有36个电子 B.C60的摩尔质量为720g
C.H2和H3属于同素异形体 D.O2和O4属于同位素
[解析]:N5+离子中的电子数是34,A错;C60的摩尔质量为720g.mol-1,B错;H2和H3 、O2和O4都属于同素异形体关系,C正确,D错误。
[答案]:C
14.(上海松江二中2009学年度第一学期期中考试) “神舟六号”所用动力燃料之一为氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,有关下列叙述中正确的是
A.等物质的量的三种物质质子数之比为1:2:3
B.等物质的量的三种物质中子数之比为1:1:1
C.等物质的量的三种物质的摩尔质量之比为8:9:10
D.三种物质的化学性质不相同
[解析]:等物质的量的三种物质质子数之比为1:1:1,中子数之比4:5:6,质量数之比为8:9:10, AB错,C正确;化学性质原子的核外电子排布,三种物质的化学性质相同,
D错。
[答案]:C
13.[江苏常州市安家中学09届高三化学试卷]月球上的每百吨 He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要与
He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要与 He的形式存在。已知一个12C原子的质量为
He的形式存在。已知一个12C原子的质量为 g,一个
g,一个 He原子的质量为
He原子的质量为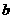 g,NA为阿伏加德罗常数值。下列说法正确的是
( C
)
g,NA为阿伏加德罗常数值。下列说法正确的是
( C
)
A. He比
He比 He多一个中子 B.氦元素的近似相对原子质量为3
He多一个中子 B.氦元素的近似相对原子质量为3
C. He的相对原子质量为
He的相对原子质量为 D.
D. He的摩尔质量为
He的摩尔质量为 NA
NA
[解析]: He比
He比 He少一个中子,A错;地球上氦元素主要与
He少一个中子,A错;地球上氦元素主要与 He的形式存在,所以氦元素的近似相对原子质量更接近4,B错;
He的形式存在,所以氦元素的近似相对原子质量更接近4,B错; He的相对原子质量为
He的相对原子质量为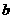 g÷ag/12=12b/a,C正确;
g÷ag/12=12b/a,C正确;
 He的摩尔质量为bNAg.mol-1,D错。
He的摩尔质量为bNAg.mol-1,D错。
[答案]:C
12.[江苏苏州中学2008-2009届第一次月考 ]已知氯元素的近似相对原子质量为35.5,由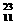 Na、
Na、 Cl、
Cl、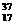 Cl构成的11.7g氯化钠,含
Cl构成的11.7g氯化钠,含 -的质量为
-的质量为
A.1.85g B.8.70g C.1.775g D.5.325g
[解析]:自然界中 Cl、
Cl、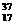 Cl的物质的量之比为a:b,35a/(a+b)+37b/(a+b)=35.5 ,
Cl的物质的量之比为a:b,35a/(a+b)+37b/(a+b)=35.5 ,
a:b=3:1
,n(NaCl)=n(Cl-)=11.7/58.5 mol=0.2moL,则n( -)=0.2mol/4=0.05mol,
-)=0.2mol/4=0.05mol,
m( -)=37×0.05g=1.85g
-)=37×0.05g=1.85g
[答案]:A
11.(安徽08高考前信息卷)短周期元素A、B、C、D、F、F的原子序数依次增大,其中A为周期表中原子半径最小的元素; B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;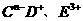 具有相同的电子层结构,E、F的质子数之和是
具有相同的电子层结构,E、F的质子数之和是 电于数的3倍。试回答下列问题:
电于数的3倍。试回答下列问题:
(1)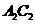 的电子式为_____________________________。
的电子式为_____________________________。
(2)由A和B两元素可以组成一种直线型的有机物Y,其密度在标准状况下约为 ,已知2克Y完全燃烧可以放出
,已知2克Y完全燃烧可以放出 量,写出表示Y燃烧热的热化学方程式:
量,写出表示Y燃烧热的热化学方程式:

(3)D与F形成的化合物其晶体结构模型如图,它代表该晶体的一个结构单元。(图中小黑点、小白圈分别代表阴、阳离子)
①此结构单元中与 距离最近且相等的
距离最近且相等的 离子个数为_____________。
离子个数为_____________。
②此晶体熔化后用惰性电极电解,其电解方程式为:__________________________________________。
(4)我国首创利用C、E两元素单质在海水中的反应所设计的原电池广泛运用于海水标示灯,该电池的正极反应式为___________________________________________。
(5)将 的最高价氧化物的水化物用适量的稀硫酸恰好溶解后,再加人1mol/L的D的最高价氧化物的水化物的水溶液后,生成沉淀39g。则加入1mol/L的D的最高价氧化物的水化物的水溶液的体积可能为____________________________________。
的最高价氧化物的水化物用适量的稀硫酸恰好溶解后,再加人1mol/L的D的最高价氧化物的水化物的水溶液后,生成沉淀39g。则加入1mol/L的D的最高价氧化物的水化物的水溶液的体积可能为____________________________________。
[解析]:短周期元素A、B、C、D、F、F的原子序数依次增大,其中A为周期表中原子半径最小的元素,则A是H元素;B原子的最外层电子数是其次外层电子数的2倍,B是C元素;C是地壳中含量最高的元素,C是O元素;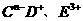 具有相同的电子层结构,则D、E是Na和Al;E、F的质子数之和是
具有相同的电子层结构,则D、E是Na和Al;E、F的质子数之和是 电于数的3倍,则F是Cl元素。有机物Y的在标准状况下约为1.16g/L,M(Y)=26g/mol
;则Y是乙炔;(1)到(4)问题解决;
电于数的3倍,则F是Cl元素。有机物Y的在标准状况下约为1.16g/L,M(Y)=26g/mol
;则Y是乙炔;(1)到(4)问题解决;
(5)1molAl2(SO4)3和1mol/L的NaOH反应,生成0.5mo l Al(OH)3,根据Al原子守恒,另外0.5molAl原子存在形式可能是Al3+或NaAlO2,所以NaOH的消耗物质的量为0.5×3mol=1.5mol或(0.5×4+0.5×3)mol,则NaOH溶液的体积是1.5L或3.5L。
[答案]:(1)
(2)
(3)①12 ② 2NaCl(熔融) 2Na+Cl2↑
2Na+Cl2↑
(4) (5)1.5L或3.5L。
(5)1.5L或3.5L。
10.[南海中学2007-2008学年度第一学期高三月测]简单原子的原子结构可用下图形象地表示:

其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是
A.①②③互为同素异形体 B.①②③互为同位素
C.①②③是三种化学性质不同的粒子 D.①②③具有相同的质量数
[解析]:根据图像,①②③分别是1H、2H、3H。
[答案]:B
9、(08江苏王集中学模拟考试)若原子核外电子的排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2,则元素周期表中第三、第四、第五周期含有的元素分别有
A.5种、10种、15种
B.8种、18种、18种
C.8种、10种、15种
D.9种、10种、15种
[解析]:根据排布规律第一、第二、第三、第四、第五周期最后一种元素的还未电子排布分别是:2 ;2、5;2、8、5;2、8、10、5;2、8、15、10、5 ;所以它们含有元素的数目分别是2;5;8;10;15。
[答案]:C
8. (08届广东东莞高三第一次调研)贫铀炸弹是一种杀伤力很强的武器。贫铀是提炼铀235后的副产品,其主要成分是铀238。贫铀炸弹不仅有很强的穿甲能力,而且铀238具有放射性,人长期受到核辐射会患皮肤癌和白血病。以下关于铀元素的叙述正确的是( )
A. 23892U原子中中子数比核外电子数多146个
B. 23892U和 23592U互为同素异形体
C.铀元素位于元素周期表的第六周期
D.铀元素属于过渡元素
[解析]:23892U原子中中子数比核外电子数多54个,A错;23892U和 23592U互为同位素,B错;92号元素位于第七周期,第三副族,C错,D正确。
[答案]:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com