
题目列表(包括答案和解析)
2.(2004全国春季理综.12)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是 ( B )
A.CH3OH(l)+ O2(g)
O2(g) CO2(g)+2H2O(l) △H=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=+1452 kJ/mol
[解析]:1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则1mol甲醇放热725.8kJ
[答案]B
1.(2003江苏卷.4)已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
A C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g) △H=-48.40kJ·mol-1
B C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1) △H=-5518kJ·mol-1
C C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1) △H=+5518kJ·mol-1
D C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1) △H=-48.40kJ·mol-1
[解析]:1mol C8H18完全然受放出的热量是114×48.40kJ=5518kJ,所以那个是可知。
[答案]:B
2、盖斯定律在科学研究中具有重要意义。因为有些反应进行的很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。此时如果应用盖斯定律,就可以间接的把它们的反应热计算出来。
例如:C(S)+0.5O2(g)=CO(g)
 上述反应在O2供应充分时,可燃烧生成CO2、O2供应不充分时,虽可生成CO,但同时还部分生成CO2。因此该反应的△H无法直接测得。但是下述两个反应的△H却可以直接测得:C(S)+O2(g)=CO2(g) ;
△H1= - 393.5kJ/mol
上述反应在O2供应充分时,可燃烧生成CO2、O2供应不充分时,虽可生成CO,但同时还部分生成CO2。因此该反应的△H无法直接测得。但是下述两个反应的△H却可以直接测得:C(S)+O2(g)=CO2(g) ;
△H1= - 393.5kJ/mol
CO(g) +0.5 O2(g)=CO2(g) ;△H2= - 283.0kJ/mol
根据盖斯定律,就可以计算出欲求反应的△H3。
分析上述反应的关系,即知
△H1=△H2+△H3
△H3=△H1-△H2=-393.5kJ/mol-(-283.0kJ/mol)
=-110.5kJ/mol
由以上可知,盖斯定律的实用性很强。
[考查方向]这部分内容只要考查学生对焓变的理解和盖斯定律理解和应用,根据反应物的用量写热化学方程式,根据热化学方程式求反应热,根据盖斯定律和已知热化学反应方程式写未知热化学方程式,可能在选择题中单独考查,也可能在选择题中其中一个选择支考查,更常见的在主观推断题应用中考查。
1、
2、 理解化学键和焓变的关系,参加反应的反应物的总能量、生成物的总能量和焓变的关系。并能推理和计算。
[能力解读]
根据热化学方程式、盖斯定律和燃烧热的数据,可以计算一些反应的反应热。反应热、燃烧热的简单计算都是以它们的定义为基础的,只要掌握了它们的定义的内涵,注意单位的转化即可。
热化学方程式的简单计算的依据:
(1)热化学方程式中化学计量数之比等于各物质物质的量之比;还等于反应热之比。
(2)热化学方程式之间可以进行加减运算。

 [考点突破]
[考点突破]
[考纲解读]
1、 了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。
预测1、下列说法正确的是( )
A、我国最近合成的一种新核素 ,该核素形成的最高价氧化物的水化物的相对分子质量为98
,该核素形成的最高价氧化物的水化物的相对分子质量为98
B、某元素的一种核素X失去两个电子,电子数为a ,中子数为b,该元素的相对原子质量约为a+2+b
C、活泼金属元素R有某种同位素的氯化物RClX,该氯化物中R微粒核内中子数为Y,核外电子数为Z,该核素可以表示为
D、某元素的一种核素X的质量数是A,含有N个中子,HmX分子,ag 1HmX所含质子数是

[解析]:A错,因为最高价氧化物的水化物是H3PO4,P的质量数是25,所以相对分子质量为92 ;B错,因为只知道这种元素的一种核素,不知到其它核素,无法知道元素的相对原子质量。;C正确,因为Rx+中电子数是Z,质子数是Z+X,质量数是X+Y+Z。D错误,核素X的质子数是A-N, 1HmX分子的质子数是A-N+m, ag 1HmX的物质的量是ag/(A+m)g.mol-1=a/(A+m)moL,质子数是
[答案]:C
预测2、 核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核才有NMR现象。试判断下列哪组原子均可产生NMR现象( )
A.18O、31P、119Sn B.27Al、19F、12C
C.7N、15P、33As、51Sb、83Bi D.只有一个电子层的原子
[解析]:根据题目提供的信息“只有质子数或中子数为奇数的原子核才有NMR现象”。选项A中,O原子的质子数是8,中子数为18–8=8,都是偶数,不符合要求;选项B中,Al、F中子数分别为27–13=14、19–9=10,C原子质子数和中子数都是6,都为偶数,不符合要求;选项C中,质子数都为奇数,均可产生NMR现象;选项D中包括H和He两种元素,的质子数为2,质量数为4,其质子数和中子数都为2,都为偶数,不符合要求
[答案]:C
[预测依据]原子或离子中质子、中子、电子和相对质量之间的关系是理解原子结构和物质结构的基础,是高考常常考查的内容之一,结合原子世界最新科技成果,从不同侧面考查对原子结构的理解和构成原子的粒子之间的关系是命题的中心。考查方式常常以选择题形式出现,也可能在主观题中某个问题中设计

30.[江苏春晖中学高三年级2008学年第一学期十二月月考]设氯原子的质量为ag,12C原子的质量为bg,用NA表示阿伏加德罗常数的值,则下列说法正确的是
A.氯元素的相对原子质量为12/b B.mg该氯原子的物质的量为m / NA mol
C.该氯原子的摩尔质量是a NA D.ng该氯原子所含的电子数是17n/a
[解析]:根据相对原子质量的定义,氯元素的相对原子质量=ag/(bg/12)= 12a/b,AC错;
mg该氯原子的物质的量=mg/(12a/b)g.mol-1==mb/12amol,B错;
[答案]:D
29.[2008年8月学年浙江省华埠中学高三份百题精练(1)]核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中所含质子的物质的量是()
A. (A-N+8)mol
B.(A-N+2)mol
(A-N+8)mol
B.(A-N+2)mol
C. (A-N+10)mol
D.
(A-N+10)mol
D.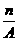 (A-N+6) mol
(A-N+6) mol
[解析]:R2+离子质子数是A-N, 它的氧化物RO, n g它的氧化物的物质的量是n/(A+16)mol, RO的质子数是A-N+8 A正确
A正确
[答案]:A
28、[江苏省前黄高级中学国际分校09届上学期综合练习一] “神舟七号”的燃料是氢化锂三兄弟--LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是
A.质子数之比为1::2:3 B.中子数之比为1:1:1
C.摩尔质量之比为8:9:10 D.化学性质不相同
[解析]:LiH、LiD、LiT的质子数都是4,A错;LiH、LiD、LiT的中子数分别是4、5、6,B错;LiH、LiD、LiT的相对分子质量分别是8、9、10,C正确;化学性质相同,D错误。
[答案]:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com