
题目列表(包括答案和解析)
12、(2008全国Ⅱ理综.26).红磷P(S)和Cl2发生反应生成KCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
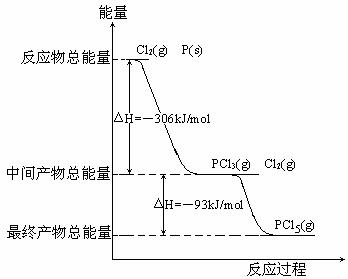 根据上图回答下列问题
根据上图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2 α1 (填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的△H3= ;P和Cl2一步反应生成1mol PCl5的△H4 △H1(填“大于”,“小于”或“等于”);
(5)P Cl5与足量水反应,最终生成两种酸,其化学方程式是 。
[解析]:根据图像(1)(2)的热化学方程式可以写出。
在密闭容器中加入0.8mol PCl5,达到平衡后还有0.6mol PCl5,分解率为25%;由于反应是吸热反应,升高温度转化率增大,α2大于α1;
(3)根据热化学方程式可知,P和Cl2反应生成中间产物PCl3是放热反应,温度太高,不利于PCl5的生成,所以降低温度,再和Cl2反应生成PCl5。
(4)根据盖斯定律,2P(s)+5Cl2(g)=2PCl5(g) △H=-798kJ/mol;生成1mol PCl5的反应热是-399kJ/mol;
(5)根据物质的组成,生成两种酸分别是磷酸和盐酸,方程式可知。
[答案]:(1)2P(s)+3Cl2(g)=2PCl3(g) △H=-612kJ/mol
(2)PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol 25% 大于
(3)因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成。
(4)-399kJ/mol 等于
(5)PCl5+4H2O=H3PO4+5HCl
11. [ 2008重庆.13]化学反应N2+3H2=2NH3的能量变化如题13图所示,该反应的热化学方程式是
A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1
C. N2(g)+
N2(g)+ H2(g)=NH3(1);
△H=(h+c-a)kJ·mol-1
H2(g)=NH3(1);
△H=(h+c-a)kJ·mol-1
D.  N2(g)+
N2(g)+ H2(g)=NH3(g);
△H=(a+b)kJ·mol-1
H2(g)=NH3(g);
△H=(a+b)kJ·mol-1
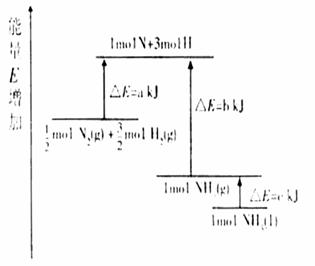
[解析]从图像分析,1/2molN2和3/2molH2放出aKJ生成1molN和3molH,逆向思考,一个反应正向放热,则逆向应是吸热且能量数值相等,所以1molN和3molH吸收bKJ生成1molNH3(g),再吸收cKJ,生成1molNH3(l),则1/2molN2和3/2molH2生成的1molNH3(l)的DH为a-b-c,将方程式扩大2倍,即为A项。
[答案]:A
10.(2008海南.8)白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1。
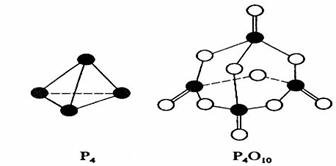
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A、(6a+5d-4c-12b)kJ·mol-1 B(4c+12b-6a-5d)kJ·mol-1
C、(4c+12b-4a-5d)kJ·mol-1 D、(4a+5d-4c-12b)kJ·mol-1
解析:由键能求反应热的公式为△H=反应物的键能总和-生成物的键能总和,则△H=6×akJ·mol-1+5×dkJ·mol-1-(12×bkJ·mol-1+4× ckJ·mol-1)=(6a+5d-4c-12b)kJ·mol-1 。故选A。
错因分析:部分同学错误使用公式:△H=生产物的总能-反应物的总能量,而错选B;另有部分同学误认为1mol白磷中含有4molP-P,而错选D。
[答案]:A
9.(2008四川.7)下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热
ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的
ΔH=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
[解析]中和热是指生成1molH2O时的反应热,与酸 、碱的元数无关,A错。燃烧热是指燃烧1mol纯物质生成最稳定的化合物所放出的热量;CO的燃烧热为283.0kJ/mol,则说明燃烧1molCO放出这些热量;其逆反应一定是吸热反应,故B对。加热是反应条件,吸热反应是反应类型,两者没有直接的关系。如煤的燃烧是放热反应,却需要加热,再如NH4Cl与Ba(OH)2的反应是吸热反应,但能在常温下迅速反应。C错。燃烧热指生成稳定的化合物,而D项中的气态水不是最稳定的化合物,应为液态水。故D错。
[答案]:B 
8、(2008北京卷.12)工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g); mol(Q>0)
mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L.min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
[解析]:根据方程式,加压平衡左移,SiCl4的转化率降低,A错;△H是指消耗SiCl41 mol的焓变,反应开始时SiCl4为1 mol,则达平衡时消耗的SiCl4小于1mol,吸收热量小于Q kJ,B错;V(HCl)=0.12 mol/L/4 min=0.03 mol/(L.min),则V(H2)=0.015 mol/(L.min),C错;
当反应吸收热量为0.025Q kJ时,生成HCl为0.1mol,D正确。
[答案]D
7.(208宁夏.13)已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mlo-1、-1411.0kJ·mlo-1和-1366.8kJ·mlo-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
A.-44.2kJ·mol-1 B.+44.2kJ·mol-1
C.-330kJ·mol-1 D.+330kJ·mol-1
[解析]根据燃烧热则:H2(g)+1/2O2(g)=H2O(l), △H = -285.8kJ ·mol-1;
C2H4(g) +3O2(g)=2H2O(l)+2CO2(g) , △H = -1411.0kJ·mol-1;
C2H5OH(1) +3O2(g)=3H2O(l)+2CO2(g) , △H = -1366.8kJ·mol-1
根据盖斯定律可得:C2H4(g)+H2O(l)=C2H5OH(l),△H= -44.2kJ·mol-1
[答案]:A。
6.(2007年高考理综重庆卷.13)已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1 mol H-H键断裂时吸收热量为( )
(A)920 kJ (B)557 kJ (C)436 kJ (D)188 kJ
[解析]1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,2mol氢气完全燃烧放出的热量为484KJ,2H2+O2=2H2O,则2Q+496 KJ-4×463 kJ= -484KJ,Q=436 KJ.
[答案]C。
5.(2006天津.13)已知反应:①101Kpa时,2C(s)+O2(g)==2CO(g);△H= -221 kJ/mol
②稀溶液中,H +(aq)+OH -(aq)== H2O(1);△H= -57.3kJ/mol
下列结论正确的是
A.碳的燃烧热大于 110.5 kJ/mol
B.①的反应热为 221 kJ/mol
C.稀硫酸与稀 NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀 NaOH溶液反应生成 1mol水,放出 57.3kJ热量
[解析]:A正确,因为CO继续燃烧产生CO2放出热量;①的反应热为 -221 kJ/mol ,B错;
[答案]:A
4、(05全国卷I.13)已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则
乙炔燃烧的热化学方程式正确的是
A.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = -4b KJ/mol
B.C2H2(g) + 5/2O2(g) == 2CO2(g) + H2O(l);△H = 2b KJ/mol
C.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = -2b KJ/mol
D.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = b KJ/mol
[解析]: 生成1mol二氧化碳气体消耗的乙炔是0.5mol,所以每摩尔乙炔完全燃烧放出的热量为2bKJ。则2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = -4b KJ/mol
[答案]:A
3、(05江苏.4)氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g) + 1/2O2(g) = H2O(l);△H= -285.8 kJ/mol
CO(g) + 1/2O2(g) = CO2(g);△H= -283.0 kJ/mol
C8H18(l) + 25/2O2(g) = 8CO2(g) + 9 H2O(l);△H= -5518 kJ/mol
CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l);△H= -890.3 kJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
[解析]:设质量为1g,氢气、一氧化碳、辛烷、甲烷的物质的量分别是1/2 mol、1/28 mol、1/114 mol、1/16mol;放出的热量分别是285.8/2KJ=142.9 KJ、283.0/28KJ=10.1KJ、5518/114KJ=48.4KJ、890.3/16 Kj=55.6KJ;
[答案]:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com