
题目列表(包括答案和解析)
6.( 安徽09高三化学检测)根据热化学方程式:
S(g)+O2(g)=SO2(g);△H= -297.23kJ/mol。下列说法中正确的是
A.S(g)+O2(g)=SO2(l); |△H|>297. 3kJ/mol
B.S(g)+O2(g)=SO2(l);|△H|<297. 3kJ/mol
C.1mol SO2的键能总和小于1mol S和1mol O2键能之和
D.1mol SO2的键能总和等于1mol S和1mol O2键能之和
[解析]:由于等量等条件的反应物完全燃烧生成气态生成物放出的热量少,则A对,B错;
由于二氧化硫分子之间存在着能量,所以CD错。
[答案]:A
5.[常州市青龙中学09届高三化学模拟试卷]已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△ H=-Q1 kJ/mol
2H2(g)+O2(g)= 2H2O(g);△ H=-Q2 kJ/mol
2H2(g)+O2(g)= 2H2O(l);△ H=-Q3 kJ/mol
取体积比4:1的甲烷和H2的混合气112L(标况),完全燃烧后恢复到常温,放出热量为 [A ]
A.4Q1+0.5Q3 B.4Q1+0.5Q2 C.4Q1+Q3 D.4Q1+2Q2
[解析]:n(气体)=112L/22.4L.mol-1=5mol,所以甲烷和氢气的物质的量分别是4mol和1mol;由于生成液态水,根据方程式可以计算出,放出热量是4Q1+0.5Q3
[答案]:A
4.[江苏省常州市北郊中学2009届高三化学11月模拟试卷]已知反应:
①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3 kJ/mol
③红磷的化学式为P,白磷的化学式为P4,已知
P4(s)+5O2(g)=P4O10(s) △H=-3093.2 kJ/mol
4P (s)+5O2(g)=P4O10(s) △H=-2954.0 kJ/mol
下列结论正确的是
A.由条件可知:红磷转化为白磷是放热反应,所以等质量的红磷能量比白磷低
B.碳的燃烧热等于110.5 kJ/mol
C.稀硫酸与稀NaOH溶液反应的反应热△H=-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量小于57.3 kJ
[解析]:根据③两个热化学方程式得P4(s)= 4P (s) ,△H=-139.2 kJ/mol,A错;
① 中的燃烧产物是CO, 所以碳的燃烧热大于等于110.5 kJ/mol,B错;
②可知C错D正确,因为C没有说明生成多少水;醋酸电离要吸收热量。
[答案]:D
3.(安徽省皖南八校2009届高三第二次联考试题)已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) 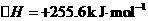
b.CH3 CH2OH(g)+ O2(g)→3H2(g)+2CO(g)
O2(g)→3H2(g)+2CO(g)
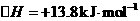
则下列说法不正确的是
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源
D.由a、b知:2 H2(g)+O2(g)=====2 H2 O(g) 
[解析]: b路线反应吸热,从平衡的角度考虑升高温度有利于提高乙醇的转化率,A错;由盖斯定律可得D正确。
[答案]:A
2.[江苏省前中国际分校2009届高三第一学期第一次调研试卷]已知下列反应的热化学方程式为:
⑴C(s)+O2(g)=CO2(g) ΔH 1=-393.5kJ/mol
⑵CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH 2=-870.3kJ/mol
⑶H2(g)+ O2(g)=H2O(l) ΔH 3=-285.8kJ/mol
O2(g)=H2O(l) ΔH 3=-285.8kJ/mol
2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为
A.488.3 kJ/mol B.-488.3 kJ/mol C.-244.15 kJ/mol D.244.15 kJ/mol
[解析]: 2C(s)+2O2(g)=2CO2(g) ΔH 1=-787.0kJ/mol
2CO2(g)+2H2O(l)=CH3COOH(l)+2O2(g)ΔH 2=+870.3kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH 3=-571.6kJ/mol
上述三个热化学方程式加和得2C(s)+2H2(g)+O2(g)=CH3COOH(l),ΔH 1=-488.3 kJ/mol
[答案]:B
1.(安徽省潜山县黄铺中学2009届高三化学调研)已知下列热化学方程式:
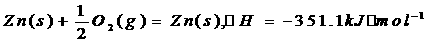

由此可知热化学方程式Zn(S)+HgO(g)=ZnO(S)+Hg(l)的反应热△H3为
A.-441 kJ·mol-1 B.-254 kJ·mol-1 C.-438.9 kJ·mol-1 D.-260.4 kJ·mol-1[解析]:根据盖斯定律

上述两个方程式加和得:Zn(S)+HgO(g)=ZnO(S)+Hg(l),△H=-260.4 kJ·mol-1
[答案]:D
⑶ P(s) + 3/4O2(g) == 1/2 P2O3(s);△H = -(20X-Y) KJ/mol
15.(05江苏.21)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC Si; SiCl4 SiO2
 (2)右图立方体中心的“●”表示硅晶体中的一个原子,
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)
该反应的反应热△H = kJ/mol.
[解析]:(1)原子晶体键能越高,则物质的熔点越高;原子晶体熔点大于分子晶体,则答案可知。(2)略
(3)根据化学反应的本质反应物的总键能减去生成物总键能就等于反应热,
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)
△H =4×347KJ/mol+2×436 KJ/mol-2×176 KJ/mol-4×431 KJ/mol=+236 KJ/mol
[答案]:
 (1)> < (2)如图
(1)> < (2)如图
(3)+236
2.75 3.55
14.(05天津.29)磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出X KJ热量。
⑴ 通过计算确定反应产物的组成(用化学式表示)是____________________,其相应的
质量(g)为________________。
⑵ 已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O3 的反应热
△H = ________________。
⑶ 写出1mol P与O2反应生成固态P2O3 的热化学反应方程式:
__________________________________________。
[解析]:(1) 4P + 3O2 = 2P2O3 , 4 P + 5O2 = 2P2O5
n(P)=0.1mol,n(O2)=0.1MOL,若只生成P2O3 ,消耗O2 3/4mol,若为P2O5消耗O2 5/4moL,所以产物是P2O3 和P2O5,根据原子守恒,2n(P2O3)+2n(P2O5)=0.1mol, 3n(P2O3)+5n(P2O5)=0.2mol,
n(P2O3) =0.025mol , n(P2O5)= 0.025mol m(P2O3) =2.75g , m(P2O5) =3.55g
(2) |△H|×0.05mol+0.05mol×Y KJ/mol=XKJ , |△H|=(20X-Y) KJ/mol, △H= -(20X-Y) KJ/mol,
(3) P(s) + 3/4O2(g) == 1/2 P2O3(s);△H = -(20X-Y) KJ/mol
[答案]:⑴ P2O3 P2O5
13、(08重庆理综·13)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )。

A.N2(g)+3H2(g)=2NH3(1);
△H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a) kJ·mol-1
C. N2(g)+
N2(g)+ H2(g)=NH3(1); △H=(h+c-a) kJ·mol-1
H2(g)=NH3(1); △H=(h+c-a) kJ·mol-1
D.  N2(g)+
N2(g)+ H2(g)=NH3(g); △H=(a+b) kJ·mol-1
H2(g)=NH3(g); △H=(a+b) kJ·mol-1
[解析]理解a、b、c的含义以及符号。a为氮气和氢气分解为氮原子和氢原子吸收的能量,b为氨分子分解为氮原子和氢原子吸收的热量,c为液态氨转化为气态氨吸收的热量。氮气氢气合成氨气的反应热包括氮气氢气分解为氮原子吸收的热量与氮原子氢原子合成氨气放出热量的相对大小,如果生成气态氨,△H=-2(b-a)kJ/mol=2(a-b)kJ/mol,如果生成液态氨△H=-2(b+c-a)kJ/mol=2(a-b-c)kJ/mol。
[答案]:A。
[点评]两种图像,两种视角,形式有别,实质相同。能量变化是化学变化的另一条线索,关注其考查方式,才能更好的理解并灵活运用能量图像解题,突破难点,形成思路方法。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com