
题目列表(包括答案和解析)
15.[2008年学年浙江省华埠中学高三11月份百题精练]热化学方程式:
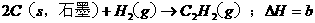
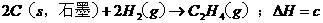
已知:a>c>b,对下列反应: ,
,
 ,则下列判断正确的是 ( C )
,则下列判断正确的是 ( C )
A.x>0,y>0 B.x <0,y >0 C.x >0,y <0 D.x <0,y <0
[解析]:
本题考查盖斯定律的应用。根据盖斯定律:化学反应的反应热只与体系的始态和终态有关,而与反应的途径无关。故 ,
, ,故正确选项为C。
,故正确选项为C。
[答案]:C
14.(哈尔滨九中2008-2009高三第二次月考)分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
 (2)如右图所示,仪器A的名称是_______________;在实验过程中,
(2)如右图所示,仪器A的名称是_______________;在实验过程中,
如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温
度,则测得的△H (填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶
液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
|
实验序号 |
起始温度t1℃ |
终止温度t2℃ |
|
|
盐酸 |
氢氧化钠 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=________________;(结果保留一位小数)
(4) (填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是 。
[解析]:(1)(2)见答案;(3)根据表中数据可知:平均温度升高3.1℃,混合物质量是
80g, Q=cm△T=4.18J/(g·℃)×80g×3.1℃=1.036KJ;所以1mol生成时的反应热为1.036KJ/0.02mol=-51.8 kJ/mol;(4)见答案。
[答案]:(1)1/2H2SO4(aq)+ 1/2 Ba(OH)2(aq)== 1/2BaSO4(s)+H2O(1);△H=-57.3kJ/mol
H+(aq)+OH-(aq)=H2O(1);△H = -57.3kJ·mol-1
(2)环形玻璃搅拌棒 偏大
(3)-51.8 kJ/mol
(4)不能, H2SO4与Ba(OH)2反应生成的BaSO4沉淀的生成热会影响反应的反应热
13. [徐州市第三十六中学2008-2009学年高三第一学期期中考试]工业上制备BaCl2的工艺流程图如下:
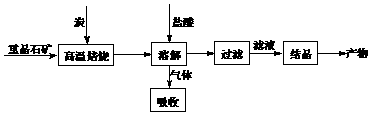
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)
+ 4C(s) 4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
BaSO4(s)
+ 2C(s) 2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1
②
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1
②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是 ,
[解析]:(1)见答案;(2)C(Br-)=5.4×10-13/C(Ag+), C(Cl-)=2.0×10-10/C(Ag+),
C(Br-)/ C(Cl-)=2.7×10-3 ;
(3)根据盖斯定律,①-②得C(s) + CO2(g) 2CO(g)的△H2=172.5
kJ·mol-1
2CO(g)的△H2=172.5
kJ·mol-1
(4)见答案
[答案]:.⑴S2- + H2O HS- +OH- HS- + H2O
HS- +OH- HS- + H2O H2S +OH-(可不写)
H2S +OH-(可不写)
⑵2.7×10-3 ⑶172.5 ⑷使BaSO4得到充分的还原(或提高BaS的产量)
①②为吸热反应,炭和氧气反应放热维持反应所需高温
12.(淮安市2009届高三年级十月四校联考) “西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,二者的体积比为1∶1。已知1mol CO气体完全燃烧生成CO2气体放出283kJ热量:1mol氢气完全燃烧生成液态水放出286kJ热量;1mol CH4气体完全燃烧生成CO2气体和液态水放出890kJ热量。
(1)写出氢气完全燃烧生成液态水的热化学方程式
(2)若1mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量 890kJ
(填>、=、<=
(3)忽略水煤气中其他成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为 ;燃烧生成的CO2的质量比约为 。
(4)以上数据和计算说明,以天然气代替水煤气作用燃料,突出的优点是
。
[解析]: (1)略;(2)气态水变成液态水要放出热量,根据热化学方程式,1mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量小于890kJ;
(3)设得到相等的热量需要水煤气与甲烷的物质的量比约为x:y, 283kJ.x/2+286kJ.x/2=890kJ.y, X:Y=3∶1 ;
生成CO2的物质的量比为3/2:1= 3∶2
[答案]:(1)2H2(g)+O2(g) = 2H2O(l) △H= -572kJ·mol-1
(2)<; (3) 3∶1 3∶2
(4)燃烧产生的热量高;CO2排放量少,有利于保护环境

11、(黄山市田家炳实验中学2008年高三第三次月考)(6分)承担神舟七号飞船发射任务的长征二号F型运载火箭,使用四氧化二氮和偏二甲肼(1,1-二甲基联氨)作为推进剂。
已知偏二甲肼:熔点: -57°C、 沸点: 63°C ,相对分子质量为60。含C:40%,H:13.33%,其余为N。回答下列问题:
⑵ 二甲肼的分子式是____________。
⑵已知5.00g偏二甲肼在液态四氧化二氮完全燃烧,生成CO2、液态H2O和N2,放出212.5kJ热量。请写出该反应的热化学方程式:_________________________________。
[解析]:N(C)=60×40%÷12=2; N(N)=60×46.67%÷14=2; N(H) =8;分子式C2H8N2
[答案]:⑴ C2H8N2 ⑵ C2H8N2(l)+2N2O2(l) = 2CO2(g)+4H2O(l)+3N2(g) ΔH=-2550kJ / mol
10.[浙江09届高 三 化 学第一学期期末考试]下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:
2H2O(l)=2H2(g)+O2(g);△H=+285.5 kJ·mol-1
B.已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ·mol-1,
则石墨的燃烧热为110.5 kJ·mol-1
 C.已知N2(g)+3H2(g) 2 NH3(g)
;△H=-92.4 kJ·mol-1,则在一定条件下将
C.已知N2(g)+3H2(g) 2 NH3(g)
;△H=-92.4 kJ·mol-1,则在一定条件下将
1molN2和3molH2置于一密闭容器中充分反应后,最多可放出92.4kJ的热量
D.已知乙醇和乙烯的燃烧热分别为1366.8kJ·mol-1和1411.0 kJ·mol-1,
则乙烯水化制乙醇的热化学方程式为:
C2H4(g)+H2O(l)=C2H5OH(l);△H=-44.2kJ·mol-1
[解析]: 氢气的燃烧热为285.5 kJ·mol-1, 则2H2O(l)=2H2(g)+O2(g);△H=+571 kJ·mol-1,A错;B错,因为燃烧热是指1mol可燃物完全燃烧生成稳定常温常压氧化物放出的热量;
C错,由于反应不能进行彻底,放出的热量一定小于92.4kJ;D正确,根据盖斯定律可以知道。
[答案]:D
10.[南海一中2008年高三高考模拟考化学科试题一]已知:
①1molH2分子中化学键断裂时需要吸收436kJ的能量,②1molCl2分子中化学键断裂时需要吸收243kJ的能量;③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量,
下列叙述正确的是
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气与氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气与氯气反应生成2mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气与氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol
[解析]: △H=1×436kJ.mol-1+1×243Kj. mol-1-2×431kJ. mol-1=-183kJ/mol
[答案]:C
9.[皖南八校2009届高三第二次联考12月]一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+ 3H2O==2NH3+ O2.
O2.
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
|
T/℃ |
30 |
40 |
50 |
生成NH3量/(10 mo1) mo1) |
4.8 |
5.9 |
6.0 |
请回答下列问题:
 (1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为
mol/min。
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为
mol/min。
(2)该反应过程与能量关系可用右图表示.完成反应的热化学方程式: 。
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(4)工业合成氨的反应为N2(g)+3 H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
① 该条件下反应2NH3(g) N2(g)十3H2(g)的平衡常数为
。
N2(g)十3H2(g)的平衡常数为
。
② 相同条件下,在另一相同容器中充人a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.8
mo1,H2为2.0 mol,则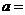 ,
,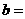 。
。
[解析]:(1)

(4)① N2(g)+ 3H2(g) 2NH3(g)
2NH3(g)
起始 /mol 0.80 1.60 0
/mol 0.80 1.60 0
转化 /mol
/mol  3
3 2
2
平衡n/mol 0.80- 1.60一3
1.60一3 2
2
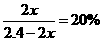
解得:
则
② 由温度相同知 设平衡时N2物质的量为
设平衡时N2物质的量为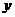
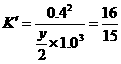

由等效转化可求起始时N2、H2的物质的量。
[答案]:(1)2.5×l0
(2)N2(g)+3H2O(1)=2NH3(g)+ O2(g)
O2(g)
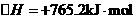
(3)升高温度;加压;不断移出生成物脱离反应体系(合理均可)
(4)①0.9375 ②0.7 3. 2
8.(哈尔滨九中2008-2009高三第二次月考)有关键能数据如表
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s);△H = -989.2kJ·mol-1,则X的值为
A.423.3 B.460 C.832 D.920
[解析]:每摩尔Si含有2molSi-Si键, 每摩尔 SiO2含有4molSi-O键,
则:△H =2×176 kJ·mol-1+498.8 kJ·mol-1- 4X kJ·mol-1 =-989.2kJ·mol-1,X=460
[答案]:B
7、(广东广州花都区2009届高三化学期初调研试题)、工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)=Si(s)+4HCl(g); mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是(
)
mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是(
)
A.反应过程中,若压缩容器体积增大压强不能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L/min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
[解析]:A正确,因为加压平衡左移;B错,因为可逆反应不能进行彻底,吸收热量小于Q kJ;C错,△C(H2)= △C(HCl)/2=0.06 mol/L,V(H2)= 0.06 mol/L÷4 min=0.015 mol/(L/min);
D正确,因为反应吸收热量为0.025Q kJ时,生成的HCl为0.1mol.
[答案]:AD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com