
题目列表(包括答案和解析)
5.类比推理是化学学习中的一种重要方法。下列类推结论中,正确的是A
|
|
类比对象 |
结论 |
|
A |
 HCl + NH3 NH4Cl HCl + NH3 NH4Cl |
 HBr + PH3 PH4Br HBr + PH3 PH4Br |
|
B |
 Cl2+2 Fe Cl2+2 Fe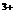 2 Fe 2 Fe +2
Cl +2
Cl |
 I2+2 Fe I2+2 Fe 2 Fe 2 Fe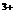 +2
I +2
I |
|
C |
 S+Fe △ FeS S+Fe △ FeS |
 S+Cu △ CuS S+Cu △ CuS |
|
D |
Ca(ClO)2 + CO2 + H2O =CaCO3↓ + 2HClO |
Ca(ClO)2 + SO2 + H2O =CaSO3↓ + 2HClO |
4.下列实验问题的处理方法中,正确的是B
A.实验中不慎打破温度计,可用吹风机加快水银(Hg)的蒸发
B.在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度
C.实验结束后,将废液倒入下水道排出实验室,以免污染实验室
D.NH3制取实验中,将多余NH3用导管直接导入水槽,用水吸收
2.下列说法中,正确的一组是C
① H、
H、 H、
H、 H是氢元素的三种核素;②冰、干冰、冰醋酸都是纯净物;③镀锌铁和镀锡铁的镀层破坏后,铁都容易狙蚀;④向大气中大量排放SO2、NO2可CO2,都会导致酸雨;⑤使用光导纤维长距离输送电流,可以降伏电能损耗;⑥饮用水可用漂白粉或明矾来处理,但二者的使用原理不同
H是氢元素的三种核素;②冰、干冰、冰醋酸都是纯净物;③镀锌铁和镀锡铁的镀层破坏后,铁都容易狙蚀;④向大气中大量排放SO2、NO2可CO2,都会导致酸雨;⑤使用光导纤维长距离输送电流,可以降伏电能损耗;⑥饮用水可用漂白粉或明矾来处理,但二者的使用原理不同
A.①④⑥ B.②③④ C.①②⑥ D.②③⑥
 3.下列各组数据中,其比值为2:1的是A
3.下列各组数据中,其比值为2:1的是A
A.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH ):c(SO
):c(SO )
)
B.相同温度下,0.2mol /L乙酸溶液与0.1mol /L乙酸溶液中,c(H+)之比
C.Na2CO3溶液中,c(Na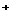 ):c(CO
):c(CO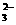 )
)
D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c(Ba(OH)2):c(KOH)
1.“神七”飞天,标志着中国的航空铝材处于领先世界的行列。下面关于铝合金的说法中,错误的是D
A.铝合金是一种混和物,它比纯铝的熔点低
B.高温铝液易被氧化,铝合金应在熔剂层覆盖下熔炼
C.镁铝合金在冷的浓H2SO4中钝化
D.镁铝合金耐腐蚀,但能被烧碱(NaOH)腐蚀
预测1。“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H = -142.9 kJ·mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H = -285.8 kJ·mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H = -571.6 kJ·mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8 kJ·mol-1
 (2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
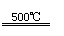 ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
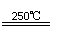 ③HgBr2+CaO
HgO+CaBr2 ④2HgO
2Hg+O2↑
③HgBr2+CaO
HgO+CaBr2 ④2HgO
2Hg+O2↑
你认为该方法的主要缺点是 。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘

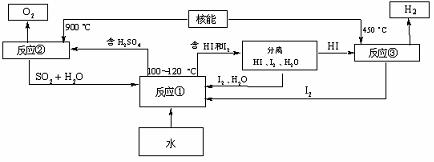
请写出反应①的化学方程式: ;
用此法制取氢气最大的优点是: ;
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:, ; 。
[解析]:(1)1gH2为0.5moL,所以1molH2放出热量285.5KJ,由于热化学方程式反应热与系数有关,所以BC都对 (2)根据四个方程式的物质和条件可以看出:生产中有污染性物质Hg和HBr等,整个过程需要较多的能量。(3)根据流程观察看出:①的反应物是SO2、I2和水,所以反应是SO2+I2+2H2O
(2)根据四个方程式的物质和条件可以看出:生产中有污染性物质Hg和HBr等,整个过程需要较多的能量。(3)根据流程观察看出:①的反应物是SO2、I2和水,所以反应是SO2+I2+2H2O 2HI+H2SO4;在整个反应中SO2和I2可以封闭循环使用没有副产物。(4)是开放性答案,说出你回答结果的原因即可
2HI+H2SO4;在整个反应中SO2和I2可以封闭循环使用没有副产物。(4)是开放性答案,说出你回答结果的原因即可
[答案]:(1)BC (2)循环过程需要很高的能量,且使用重金属汞,会产生污染。
(3) SO2+I2+2H2O 2HI+H2SO4 SO2和I2可循环使用,无污染。
2HI+H2SO4 SO2和I2可循环使用,无污染。
(4)不现实。理由是现有的制取氢气方法耗能大,制取的成本太高;另外是氢气的熔沸点太低,给储存和运输带来困难。(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等)
预测2. 美国《科学美国人》杂志1971年7月刊登的地球的能源提供了如下数据表明了到达地球表面的太阳能辐射能的主要几条去路(单位:kJ/S)
|
直接反射 5.2×1013 |
水循环 4×1013 |
大气流动 3.7×1011 |
光合作用 4×1010 |
以热能方式离开地球8.1×1013/S |
请通过以上数据计算
① 地球对太阳能的利用率为 ;
② 通过光合作用每年 太阳能转化为化学能(每年按365天计算)
③ 每年的绿色植物通过光合作用为我们的生活环境除去二氧化碳的质量为A试根据能量关系列出A的计算式。列式中缺少的数据用符号表示 A= 所缺数据的化学含义是
。
A= 所缺数据的化学含义是
。
[解析](1)太阳总能量是以上表格各项的和,其数值为1.734×1014 kJ/S,水循环、大气流动、光合作用为地球所利用的能量,其数据为4.04×1013kJ/S,其中的利用率为(4.04×1013kJ/S)÷1.734×1014 kJ/S×100%=23.3%。
(2)小问不难算出,共数据为1.26×1018kJ.
(3) 由植物的光合作用的反应式6CO2+6H2O→C6H12O6+O2可知,只要知道生成1mol C6H12O6所需要吸收的能量就可以算出二氧化碳的质量 设吸收的能量为QkJ/mol,A=3.33×1017/Q
设吸收的能量为QkJ/mol,A=3.33×1017/Q Q为生成1mol C6H12O6所需要吸收的能量
Q为生成1mol C6H12O6所需要吸收的能量
[答案]:(1) 23.3% (2)1.26×1018kJ (3) Q为生成1mol C6H12O6所需要吸收的能量
[点评]在目前越来越强调培养综合型、创新型人才环境下,这类跨学科间的考查要引起我们足够的重视

31、(山东青岛一中2009级高三第二次月考)下列说法或表示方法正确的是()
A.需要加热发生的反应是吸热反应
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H = –57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨)→C(金刚石);△H = +73 kJ/mol,可知金刚石比石墨稳定
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H = +285.8kJ/mol
[解析]:A错,很多放热反应也需要加热;B正确,因为浓硫酸稀释放出热量;C错,石墨稳定;D错,因为氢气燃烧发热,△H 小于零。
[答案]: B

30.[南海中学西樵分校2007-2008学年度第一学期高三3月测试].已知下列几种烷烃的
燃烧热数据如下:
|
烷烃 |
甲烷 |
乙烷 |
丙烷 |
丁烷 |
|
燃烧热/(kJ/mol-1) |
890 |
1560 |
2220 |
2880 |
据此判断,表示戊烷燃烧的热化学方程式正确的是
A.C5H12(l) + 8O2(g) = 5CO2(g) + 6H2O(l);△H = - 3540 kJ/mol
B.C5H12(l) + 8O2(g) = 5CO2(g) + 6H2O(g);△H = - 3540 kJ/mol
C.C5H12(l) + 8O2(g) = 5CO2(g) + 6H2O(g);△H = + 3540 kJ/mol
D.C5H12(l) + 8O2(g) = 5CO2(g) + 6H2O(l);△H = + 3540 kJ/mol
[解析]: 戊烷燃烧放热,△H小于零,产物水是液体,A正确。
[答案]:A
29. (08届东莞高三第一次调研)下列说法或表示法正确的是( C )
A.等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石);ΔH = +1.19 kJ· mol-1可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH=-57.3 kJ· mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)= 2H2O(l);ΔH=-285.8 kJ· mol-1
[解析]:固体白磷变成气体白磷要吸收热量,A错;C(石墨)→C(金刚石)吸收热量,石墨稳定,B错;浓硫酸稀释放出热量,C正确;燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,D错。
[答案]:C
28、(08广州3月模拟)已知:(1)Zn(s)+1/2O2(g)==ZnO(s),ΔH=-348.3kJ/mol
(2) 2Ag(s)+1/2 O2(g)== Ag2O(s),ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8 kJ/mol D.317.3 kJ/mol
[解析]:根据盖斯定律A正确
[答案]:A
27、 [2008年上海市部分重点中学高三联考化学]
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN
[2008年上海市部分重点中学高三联考化学]
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN N放出942kJ热量。根据以上信息和数据,下列说法正确的是
N放出942kJ热量。根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物 B.N4沸点比P4(白磷)高
C.N4分子存在非极性键 D.1molN4气体转变为N2将吸收882kJ热量
[解析]: 根据键能N4气体转变为N2将放出热量,N4属于单质,N4沸点比P4(白磷)低。
[答案]:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com