
题目列表(包括答案和解析)
8.下列溶液中,各组离子一定能够大量共存的是
A.无色溶液中:K+、H+、SO32-、MnO4-
B. 的溶液中:K+、Na+、CO32-、AIO2-
的溶液中:K+、Na+、CO32-、AIO2-
C.能使pH试纸变红的溶液中:Ca2+、Na+、CO32-、SO42-
D.含有大量Fe3+的溶液中:H+、Mg2+、I-、SCN-
7.可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液的试剂是
A.银氨溶液 B.新制氢氧化铜悬浊液 C.石蕊试液 D.碳酸钠溶液
6..2008年夏季奥运会将在我国举行。奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KC1O3+6P 3P2O5+5KC1。下列有关该反应的叙述中,正确的是
A.反应中红磷是氧化剂
B.反应中消耗3molP时,转移电子的物质的量为15mol
C.“火药”中的红磷可以用白磷代替
D.发令时产生的白烟只是KC1固体颗粒
5.下列叙述正确的是
A.22.4L的水在标准状况下是1mol
B.0.1mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质
C.给pH=12的NaOH溶液通电一段时间后溶液的pH > 12
D.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
4.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
3.从下列事实所得出的相应结论正确的是
|
|
实验事实 |
结论 |
|
① |
SO2的水溶液可以导电 |
SO2是电解质 |
|
② |
将燃烧的镁条放入CO2中能继续燃烧 |
还原性:Mg>C |
|
③ |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
|
④ |
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液中一定有NH4+ |
A.③④ B.②④ C.①② D.全部
2.物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是
A.①②③⑤ B.①②⑤ C.②⑤⑥ D.①④⑤⑥
1.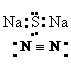
 下列各项表达式正确的是
下列各项表达式正确的是
A.O2-的结构示意图: B.Na2S的电子式:
C.乙烯的结构简式:C2H4 D.氮分子的结构式:
27.根据下列某些短周期元素中元素性质的有关句回答问题。
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径/10-10m |
0.37 |
1.86 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.52 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
|
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
|
|
最低价态 |
-1 |
|
-2 |
|
-4 |
-3 |
-1 |
|
-3 |
-1 |
(1)元素①、②和⑧的第一电离能由大到小的顺序是_________(填元素符号);元素③、⑥和⑨的氢化物中非典由高到低的顺序是__________(填化学式)。
(2)元素⑤、⑥和⑦的某两种元素形成的化合物中,每个原子都 满足最外层为8电子稳定结构的物质是__________(写化学式)。
(3)某元素R的原子半径为1.02×10-10m,它与钠形成Na2R2,其化学键类型有________,其电子式是_________(R用元素符号表示)。
(4)元素①和⑨形成阳离子 ,其结构式为_________,其中心原子以_______杂化轨道成键。
(5)元素⑤的原子基态电子排布式为____________。
(6)元素②和⑦形成晶体的部分结构可用下图中的______来表示(填序号)。

26.有机物结构可用“键线式”表示。如CH3-CH2-CH2-COOH可表示为: 卡托普列(Captopril)临床用于治疗高血压和充血性心力衰竭。它最有价值的合成路线为:
卡托普列(Captopril)临床用于治疗高血压和充血性心力衰竭。它最有价值的合成路线为:

已知A的相对分子质量不超过100,它与Na或Na2CO3反应都能产生无色气体,还能使Br2/CCl4溶液褪色,A完全燃烧只生成CO2和H2O。
核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。A的核磁共振氢谱如下图:

试完成下列问题
(1)A的结构简式为:____________ ;反应②的反应类型是_________ (2)上图反应中,符合绿色化学思想(原子利用率100%)的是第______ 步(填反应序号)
(3)已知反应③为取代反应,则C5H9NO2的结构简式为: ________
(4)A的甲醇酯是合成有机玻璃的单体,写出合成有机玻璃的化学方程式:_______________
(5)已知羧基(-COOH)pKa=3.7,巯基(-SH)pKa=9.8,H2O的pKa=16,pKa越小,酸性越强,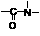 能在碱性条件下水解。则1molE最多能与_____molNaOH完全反应。(Ka是平衡常数,pKa=-lgKa)
能在碱性条件下水解。则1molE最多能与_____molNaOH完全反应。(Ka是平衡常数,pKa=-lgKa)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com