
题目列表(包括答案和解析)
16. 三聚氰胺的结构如右图。“三聚氰胺”,有个貌似美妙的别名“蛋白精”,某些广告中曾公然标榜“能提高产品蛋白含量”。三聚氰胺性状为纯白色单斜棱晶体,无味,密度1.573g/cm3.(16℃)常压熔点354℃(分解);快速加热升华,升华温度300℃,溶于热水,微溶于冷水。关于三聚氰胺,下列说法不正确的是
三聚氰胺的结构如右图。“三聚氰胺”,有个貌似美妙的别名“蛋白精”,某些广告中曾公然标榜“能提高产品蛋白含量”。三聚氰胺性状为纯白色单斜棱晶体,无味,密度1.573g/cm3.(16℃)常压熔点354℃(分解);快速加热升华,升华温度300℃,溶于热水,微溶于冷水。关于三聚氰胺,下列说法不正确的是
A, 是蛋白质
B, 是有机物,有弱碱性
C, 将购回的奶粉溶于热水后冷却,过滤,可以粗略检测其中是否含有三聚氰胺
D, 可以与盐酸反应
第II卷(非选择题 共58分)
必做题(17~21题)
15.一定温度下的难溶电解质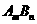 在水溶液中达到沉淀溶解平衡时,其平衡常数
在水溶液中达到沉淀溶解平衡时,其平衡常数 ,称为难溶电解质的离子积,在25℃时,
,称为难溶电解质的离子积,在25℃时, 的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀,已知有关物质的颜色和溶度积如下;
的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀,已知有关物质的颜色和溶度积如下;
|
物质 |
 |
 |
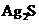 |
|
颜色 |
白 |
黄 |
黑 |
 (25℃) (25℃) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列叙述不正确的是
A. 浓度积小的沉淀可以转化为溶度积更小的沉淀
B. 若先加入足量Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.
25℃时,饱和溶液 、
、 、
、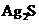 中所含
中所含 +的浓度相同
+的浓度相同
D.
25℃时, 固体在等物质的量浓度的
固体在等物质的量浓度的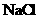 、
、 溶液中的溶度积相同
溶液中的溶度积相同
7 NA表示阿伏加德罗常数的值,下列有关NA的学术不正确的是
A 由Cu、Zn 和稀硫酸组成的原电池工作时,若Cu 极生成0.2gh2,则电路中通过的电子0.2 NA
B 在标准状况下,11.2 L ON与11.2 L O2混合后气体分子数小于0.75NA
C 1mol C4H10分子中共价键总数为13NA
D 标准状况下,22.4 L水中含质子数为10 NA
8 可能大量存在的离子组是
A 无色溶液中:H+ 、Na +、I-、ClO-
B 含有 HCO3-的溶液中:K+、Na+、SO32-、SO2-4
C 使pH试纸呈红色的溶液中:K+、Fe2+、NO-3、Cl-
D 由水电离的 的溶液中:
的溶液中:
9 被称为万能还原剂的NaBH4(其中H元素为-1价)溶于水并和水反应:
NaBH4+2H2O====NaBO2+4H2á.下列说法正确的是
A NaBH4既是氧化剂又是还原剂
B NaBO2是氧化产物
C 硼元素被氧化,氢元素被还原
D 氧化产物与还原产物的质量比为1:1
10 用下列实验装置完成对应的实验,能达到目的的是

11 X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是
A X肯定是金属元素
B Y、Z两元素可形成共价化和物
C X 的原子序数肯定小于Y和Z
D 稳定性:Y的氢化物〉Z的氢化物
12 下列离子方程式书写正确的是
A 漂白粉溶液中通入 SO2气体 Ca2++2ClO-+SO2+H2O====CaSO3â+2HClO
B 往绿化铝溶液中加入过量的氨水Al3++4NH3·H2O====[Al(OH)4]-+4NH4+
C NaHS水解HS-+H2O S2-+H3O+
S2-+H3O+
D 过量的NH4HSO4溶液与Ba(OH)2溶液反应
2H++SO2-4+Ba2++2OH-====BaSO4â+2H2
13 下列表述正确的是
A 任何能使熵值增大的过程都能自发进行
B 已知热化学方程式 + O2(g)
+ O2(g) 2SO3(g)
2SO3(g)  ,
,
则将 和1molO2(g)置于一密闭容器中充分反应后放出Q kJ 的热量
和1molO2(g)置于一密闭容器中充分反应后放出Q kJ 的热量
C 相同条件下C(s)+I/2O2(g)====GO(g) 1 C(s)+O2(g)====CO2(g)
1 C(s)+O2(g)====CO2(g) 则
则
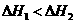
D 1molNaOH分别和1molCH2COOH、1molHHO3反应,后者必前者放出的热量多
14.经测定某种溶液中只含 、
、 、
、 、
、 四种离子,下列说法不正确的是
四种离子,下列说法不正确的是
A. 四种离子之间不可能满足:
B. 若 ,则溶质一定是
,则溶质一定是 和
和
C. 若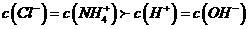 ,则溶液中溶质只有
,则溶液中溶质只有
D, 若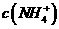
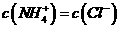 ,则溶液一定呈中性
,则溶液一定呈中性
1 下列“科学史话”中得出的结论不正确的是
A 从舍勒发现一种黄绿色气体,到戴维确认该气体为氯气,花了三十多年时间,说明科学研究要付出艰辛的劳动。
B由于化学工业的发展,历史上出现了“伦敦光化学烟雾”事件,预示着化学最终只会给人类带来灾难
C 门捷列夫发现的元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑
D 凯库勒梦其所想,从梦中得到启发,成功地提出了苯环结构,表明灵感来自于实践和思考
2 NaCl+CO2+NH3+H2O===NaHCO3â+NA4Cl是著名的“侯氏制碱法”的重要反应。
下面是4个同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
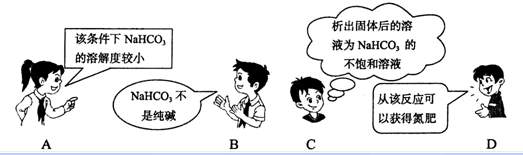
3 化学与生活密切相关,下列有关做法正确的是
A 为增加明矾净水效果,可同时加入氢氧化钡溶液
B 2009年春天为了缓解干旱,许多地方使用Agl或干冰人工降雨
C 为防止铁制品生锈,可在铁制品的外层涂油漆或局部镀铜
D 计算机硅芯片,光导纤维,普通玻璃都属于硅酸盐产品
4 2008年9月25日,“神七”成功飞天,宇航员出舱时呼吸所有需氧气主要来自太空服中的呼吸面具。下列反应均能产生氧气,其中最适宜用呼吸面具中提供氧的反应是
A 4HNO3 4HNO2á +O2á+2H2O
4HNO2á +O2á+2H2O
B 2H2O2 2H2O+O2á
2H2O+O2á
C 2Na2O2+2CO2====2Na2CO3+O2
D 2KClO3 2KCl+3O2á
2KCl+3O2á
5 下列叙述正确的是
A 非金属氧化物一定不是碱性氧化物
B 氯水、水玻璃、水银、聚乙烯都是混合物
C 漏斗、蒸馏烧瓶、分液漏斗、滴定管等仪器常用物质分
D 电解质溶液的导电过程属于物理变化
6 下列有关颜色变化描述不正确的是
A 二氧化硫通入品红溶液à无色
B 淀粉溶液遇单质碘à蓝色
C 热的氧化铜遇乙醇à绿色
D 氯化铁溶液中滴加硫氰化钾à血红色
(二)选考题:(共15分,请考生从给出的3道试题中任选一题做答。如果多做,则按所做的第一题计分。)
29.[化学--选修化学与技术](15分)
 我国有较长的海岸线,浩瀚的海洋是一个巨大物质资源和能量的宝库。目前世界各国都在研究如何充分利用海洋资源。
我国有较长的海岸线,浩瀚的海洋是一个巨大物质资源和能量的宝库。目前世界各国都在研究如何充分利用海洋资源。
(1)如右图所示,在电场中利用膜技术
(阳离子交换膜只允许阳离子通过,
阴离子交换膜只允许阴离子通过)淡
化海水,该方法称为电渗析法。
①图中膜a应选用 膜。
②电渗析法还可以用来处理电镀废液,
写出该方法处理含硫酸铜废液时(使
用惰性电极)所发生的电极反应式为:
阴极 ;阳极 。
(2)海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg·L-1。其工业提取法有:
(i)空气吹出纯碱吸收法。该法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸化,即可得到单质溴。该方法涉及的反应有:
① (写出化学反应的离子方程式);
②3Br2+2CO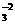 =BrO
=BrO +5Br-+3CO2↑;
+5Br-+3CO2↑;
③BrO +5Br-+6H+=3Br2+3H2O。
+5Br-+6H+=3Br2+3H2O。
其中反应中③氧化剂是 ,还原剂是 。
(ii)溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度不同的原理来进行的。实验室中萃取用到的主要玻璃仪器名称是 。下列可以用于从海水中萃取溴的试剂是(填写编号) 。①乙醇,②四氯化碳,③硝酸
 (3)海水中的氘(含HDO0.3%)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25°C和100°C两种不同的温度下发生的两个不同反应得到较高浓度的HDO。
(3)海水中的氘(含HDO0.3%)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25°C和100°C两种不同的温度下发生的两个不同反应得到较高浓度的HDO。
右图为“硫化氢-水双温交换法”所发生的两个反应中
涉及的四种物质在反应体系中的物质的量随温度的变化
曲线。写出100°C时所发生反应的化学方程式
;
工业上富集HDO的生产过程中,可以循环利用的一种
物质是 。
30.[化学--选修物质结构与性质](15分)
图表法、图象法是常用的化学科学研究方法。
下表列出前20号元素中的某些元素性质的一些数据:
元素 性质 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
原子半径 (10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
|
最高价态 |
+6 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
|
最低价态 |
-2 |
- |
-2 |
|
-4 |
-3 |
-1 |
- |
-3 |
-4 |
试回答下列问题:
(1)以上10种元素中第一电离能是小的是: (填编号)。比元素B原子序数大10的元素在元素周期表中的位置: 周期; 族,其基态原子的核外电子排布是 。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是 (写分子式,写出两种即可,)元素G、I分别和J形成的两种化合物的晶体类型分别是
。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其E分子共形成 个σ键。 个π键
(4)短周期某主族元素K的电离能情况如图(A)所示。
 则K元素位于周期表的第
族。
则K元素位于周期表的第
族。
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第
族元素氢化物的沸点的变化规律。
不同同学对某主族元素的氢化物的沸点的变化趋热画出了两条折线--折线a和折线b,你认为正确的是 ,理由是
。
31.[化学--选修有机化学基础](15分)
 目前,化学农药已进入一个超高效、低毒化、无污染的新时期。一种高效、低毒农药“杀灭菊酯”的合成路线如下:
目前,化学农药已进入一个超高效、低毒化、无污染的新时期。一种高效、低毒农药“杀灭菊酯”的合成路线如下:
 已知:
已知:
F可能发生银镜反应。请回答问题:
(1)写出A、C结构简式:A ;C 。
(2)下列变化的反应类型是:B→C ;E→F
 (3)写出下列变化的化学方程式:
(3)写出下列变化的化学方程式:
;
E→F
。
D+C
。
(4)解决有机分子结构问题的最好的手段是核磁共振氢谱(PMR)。有机化合物分子中有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰,吸收峰的面积与H原子数目成正比。在核磁共振氢谱中A物质会出现 组峰,其吸收峰的面积之比为 。
(5)写出分子中有两个苯环,还能与NaHCO3反应放出气体且与F互为的同分异构体所有有机物的结构简式: 。
(一)必考题(共5题,共44分)
24.(7分)水是生命之源,也是化学反应中的明星物质。试回答下列问题:
(1)写出水的电子式 。
(2)A、B、C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂。请写出A、B、C与水反应的化学方程式:
A+H2O ;
B+H2O ;
C+H2O 。
25.(6分)A、B、C、D常见的不同主族的短周期元素,它们的原子序数逐渐增大,其中只有一种是金属元素,D元素原子最外层电子数是C元素原子最外层电子数的二倍,B元素原子的最外层最子数比D的最外层电子数少两个。E也是短周期元素,与D同主族。
(1)写出B元素符号 ,画出E的原子结构示意图 。
(2)由上述五种元素中的三种组成的易溶于水的物质中,能促进水电离物质M的化学式是 ,其与水反应的离子方程式为
能抑制水电离的物质N的名称是 (写出一种物质即可。)
26.(8分)某溶液中可能含有CO 、SO
、SO 、HCO
、HCO 三种离子中的一种、两种或三种都有。为探究其组成,现取出两份相同的样品溶液中试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氢氧化钡溶液,产生白色沉淀。请设计合理实验,在此实验的基础上做进上步实验,得出实验结论。
三种离子中的一种、两种或三种都有。为探究其组成,现取出两份相同的样品溶液中试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氢氧化钡溶液,产生白色沉淀。请设计合理实验,在此实验的基础上做进上步实验,得出实验结论。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯、1mol/L硫酸、2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡、1mol/L氢氧化钡、澄清石灰水、蒸馏水。
完成下列探究过程:
(1)提出假设:
假设1:溶液只存在CO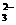
假设2: 。
假设3: 。
假设4: 。
假设5: 。
假设6:溶液中存在CO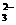 、SO
、SO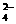 、HCO
、HCO 。
。
(2)基于假设6,设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。(可不填满,也可增加步骤)
|
步骤编号 |
实验步骤及预期现象和结论 |
|
① |
|
|
② |
|
|
③ |
|
|
④ |
|
27.(13分)、氨是重要的化工原料,合成氨是是哈伯1905年发明的。2001年希腊化学家提提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气分别通入一个加热到57°C的电解池中,H2和N2在电极上合成氨。此法的转化率大为提高。已知:
 N2(g)+3H2(g) 2NH3(g) △H<0。 请回答下列问题:
N2(g)+3H2(g) 2NH3(g) △H<0。 请回答下列问题:
(1)电解法合成氨可以使用水做电解液吗? ,为什么
。
(2)若合成氨反应容器的容积为2L,开始充入3mol/LH2和1mol/LN2反应达到平衡时气体的压强变为原来的7/8,则氮气的转化率为 。
该反应的化学平衡常数的表达式为 ,升高温度,平衡常数将 。(填增大、减少或不变);增大反应容器的体积,再达到平衡时,混合气体的平均分子量将 。(填增大、减少或不变)。
(3)在一这条件下氨可与其它物质反应生成尿素[CO(NH2)2],已知30g尿素在高温高压下分解生成11.2LNH3(标况)、5.6LCO2(标况)和一定质量的三聚氰胺分子(三聚氰胺的相对分子质量为126)。不法分子曾在低蛋白含量的奶粉中加入三聚氰胺来提高奶粉中蛋白质含量,导致许多婴儿肾结石。写出三聚氰胺的分子式 。其化学反应方程式为 。三聚氰胺分子中有一个六元杯,一个三聚氰胺分子可分解生成三个分子A,则A的结构式是 。
28.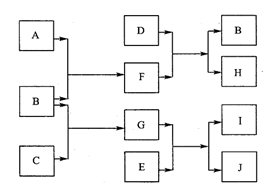 (10分)A、B、C、D、E是中学化学常见的单质,其中只有A、C在常温下为气态。E的摩尔质量是A的2倍,F、G、H、I、J5种化合物分别由上述五种元素中的两种组成。D与F反应放出大量的热。它们之间的转化关系如下图所示(反应条件已省略):
(10分)A、B、C、D、E是中学化学常见的单质,其中只有A、C在常温下为气态。E的摩尔质量是A的2倍,F、G、H、I、J5种化合物分别由上述五种元素中的两种组成。D与F反应放出大量的热。它们之间的转化关系如下图所示(反应条件已省略):
请回答下列问题:
(1)元素B在周期表的位置是:周期 ,族 。
(2)写出D与F反应的化学方程式
。该反应在工业生产中的用途是 (至少写出一点)。
已知H能与烧碱溶液反应,写出该反应的离子方程式 。
(3)若J中含有B元素,写出检验化合物J中阳离子的有关离子方程式:
。
23.已知下列热化学方程式:
Zn(s)+1/2O2(g)=ZnO(s)△H=-351.1kJ/mol
Hg(l)+1/2 O2(g)=HgO(s)△H=-90.7kJ/mol
由此可知热化学方程Zn(s)+HgO(s)=ZnO(s)+Hg(l)的反应热△H为 ( )
A.-260.4kJ/mol
B.-254.6kJ/mol
C.-483.9kJ/mol
D.-441.8kJ/mol
第Ⅱ卷(非选择题,共59分)
22.在Fe(SO4)3溶液中,加入agCu,完全溶解后,又加入bgFe,充分反应后得到cg残余固体,且a>c.则下列判断不正确的是 ( )
A.最后溶液中一定不含Fe3+ B.残余固体可能是Fe、Cu的混合物
C.最后溶液中一定含Fe2+ D.残余固体一定是Cu
21.下列叙述中错误的或违背化学原理的是 ( )
A.能形成+7价的含氧酸及其盐的元素不一定是主族元素
B.等质量的苯和乙烯完全燃烧耗氧量不相等
C.用金属钠检验乙醇中是否含有少量水
D.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
20.已知25°C时,AgI饱和溶液中c(Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol/L。若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
A.c(K+)>c(NO )>c(Ag+)>c(Cl-)>c(I-)
)>c(Ag+)>c(Cl-)>c(I-)
B.c(K+)>c(NO )> c(Cl-)>
c(Ag+)>c(I-)
)> c(Cl-)>
c(Ag+)>c(I-)
C.c(K+)>c(NO )>c(Ag+)=c(Cl-)+c(I-)
)>c(Ag+)=c(Cl-)+c(I-)
D.c(NO ) >c(K+)>c(Ag+)>c(Cl-)>c(I-)
) >c(K+)>c(Ag+)>c(Cl-)>c(I-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com