
题目列表(包括答案和解析)
15.(10分)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
[提出猜想]
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 ▲ 中的一种或两种。
[实验探究]
|
|
实验操作 |
预期现象 |
结 论 |
|
验证猜想Ⅰ |
步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液 |
▲ |
▲ |
|
步骤②: ▲ |
▲ |
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体通入如下装置 |
▲ |
含有两种气体 |
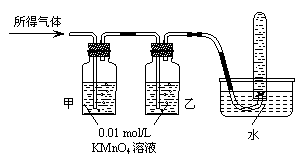

[问题讨论]
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,请对该观点进行评价: ▲ 。
14.在a LAl2(SO4)3和(NH4)2SO4的混合溶液中加入b mol的BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c molNH3,则原溶液中的Al3+的浓度(mol/L)为
A.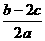 B.
B.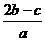 C.
C.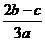 D.
D.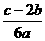
13.下列溶液中有关物质的量浓度关系正确的是
A.0.2 mol/L的NaHCO3溶液:
c(HCO3-)>c(CO32-)>0.1 mol/L>c(H2CO3)
B.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.0.2 mol/L CH3COOH溶液和0.2 mol/L CH3COONa溶液等体积混合:
c(CH3COO-)+c(OH-)-c(H+)=0.1 mol/L
D.0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合
c(CO32-)+2c(OH-)= c(HCO3-)+3c(H2CO3)+2c(H+)
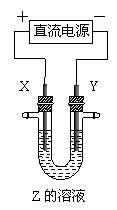
12.利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生
产。下列说法中正确的是
A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.外加电流的阴极保护法中,Y是待保护金属
11.下列实验操作能达到目的或对实验结果无影响的是
A.将5.00 mL 12 mol/L的盐酸稀释至500 mL,配制成0.1200 mol/L的盐酸
B.酸碱中和滴定前,滴定管用待装液体润洗而锥形瓶没有用待装液体润洗
 C.向浓氨水中加生石灰,将产生的气体通过碱石灰后得到干燥纯净的氨气
C.向浓氨水中加生石灰,将产生的气体通过碱石灰后得到干燥纯净的氨气
D.向FeCl3浓溶液中滴加NaOH溶液,加热至沸腾,制备Fe(OH)3胶体
10.下列反应的离子方程式书写正确的是
A.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑
B.氯气通入澄清石灰水中:Cl2+2OH-=Cl-+ClO-+H2O
C.用小苏打治疗胃酸过多: CO32-+2H+=CO2↑+H2O
D.硅酸钠溶液中通入过量二氧化碳: SiO32-+CO2+H2O=H2SiO3↓+CO32-
9.利用碱性氧化性溶液的氧化作用,在钢铁表面形成一层深蓝色的Fe3O4(也可表示为FeFe2O4)薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝。烤蓝时发生如下反应:
① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
② Na2FeO2+NaNO2+H2O-Na2Fe2O4+NH3↑+NaOH(未配平)
③ Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
下列说法中正确的是
A.Fe3O4既可看作是氧化物,又可看作是亚铁盐
B.反应②配平后,H2O的化学计量数为3
C.反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂
D.碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强
8.在下列溶液中,各组离子一定能够大量共存的是
A.pH=2的溶液: Fe3+、Cu2+、SO42-、NO3-
B.c(H+)=1×10-12mol/L的溶液:NH4+、K+、Cl-、AlO2-
C.水电离的c(H+)=1×10-12mol/L的溶液:Na+、Al3+、Br-、ClO-
D.与铝反应放出氢气的溶液:Na+、Mg2+、Br-、Cl-
7.下图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是
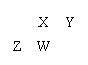 A.原子半径:W>Z>Y>X
A.原子半径:W>Z>Y>X
B.气态氢化物的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值可能相等
D.Z的最高价氧化物的水化物可能为强碱
6.设阿伏加德罗常数的值为NA。下列叙述正确的是
A.1.0L0.1mol/L的NH4Cl溶液中NH4+的个数为0.1NA
B.常温下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数为0.1NA
C.常温下,0.05mol CO2和SO2混合气体中所含氧原子数为0.1NA
D.高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com